适用年级:{{getGradeNameByProperty('高三|月考试卷|福建|2016年')}} 试卷类型:{{getTestPaperTypeName('高三|月考试卷|福建|2016年')}} 使用省份:{{getAreaName('高三|月考试卷|福建|2016年')}}
试卷年份:{{getYear('高三|月考试卷|福建|2016年')}}上传日期:2016-05-11题数:13
提示:单击题文可显示答案与解析。
题号:3134532
题型:选择题
难易度:一般
日期:2016-05-24
来源:2016届福建省龙岩市高中毕业班3月质量检查理综化学试卷(带解析)
【题文】下列实验中,所采取的实验方法(或操作)与对应的原理都正确的是( )
选项
| 实验
| 方法(或操作)
| 原理
|
A
| 分离溶于水中的溴
| 植物油萃取
| 溴在植物油中的溶解度较大
|
B
| 分离乙酸乙酯和乙醇
| 分液
| 乙酸乙酯和乙醇的密度不同
|
C
| 从蛋清中提取蛋白质
| 加入硫酸铜溶液
| 浓盐溶液使蛋白质溶解度降低
|
D
| 尿液中尿糖的检验
| 加入新制Cu(OH)2、加热
| 葡萄糖具有还原性
|
题号:3138801
题型:选择题
难易度:一般
日期:2016-05-11
来源:2016届福建省龙岩市高中毕业班3月质量检查理综化学试卷(带解析)
【题文】含硝基苯(C
6H
5NO
2)的工业废水常用铝粉处理。其机理为:在溶液中,铝单质提供电子将硝基(-NO
2)还原为-NH
2,还原快慢受废水pH影响。下列图示中,能正确反映废水的pH与硝基苯被还原速率(
v)关系的是
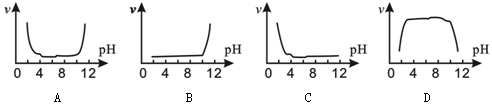
题号:3138802
题型:选择题
难易度:一般
日期:2016-05-11
来源:2016届福建省龙岩市高中毕业班3月质量检查理综化学试卷(带解析)
【题文】分子式为C
5H
10O
2并能与NaOH溶液反应的有机构有(不含立体异构)
题号:3138803
题型:选择题
难易度:一般
日期:2016-05-11
来源:2016届福建省龙岩市高中毕业班3月质量检查理综化学试卷(带解析)
【题文】已知:主族元素X、Y、Z、W原子序数依次增大;X、W同主族,且X
—的电子层结构与氦相同;Y、Z原子次外层电子数均为8、最外层电子数之和为13。下列说法不正确的是
| A.原子半径为次序为W>Y>Z |
| B.Y、W形成的化合物水溶液显碱性 |
| C.对应氢化物的稳定性:Y>Z |
| D.W与X、Y、Z均能形成离子化合物 |
题号:3138804
题型:选择题
难易度:一般
日期:2016-05-11
来源:2016届福建省龙岩市高中毕业班3月质量检查理综化学试卷(带解析)
【题文】设N
A为阿伏加德罗常数的数值,下列叙述正确的是
| A.室温下,1 L pH=12的氨水溶液中含有0.01NA个NH4+ |
| B.1molFeCl3与沸水反应生成胶体后,含有NA个Fe(OH)3胶粒 |
| C.常温常压下,11.2L O2和O3的混合气体含有0.5NA个分子 |
| D.78g Na2O2固体中含有离子总数必为3NA |
题号:3138806
题型:选择题
难易度:一般
日期:2016-05-11
来源:2016届福建省龙岩市高中毕业班3月质量检查理综化学试卷(带解析)
【题文】汽车尾气含氮氧化物(NO
X)、碳氢化合物(C
XH
Y)、碳等,直接排放容易造成“雾霾”。因此,不少汽车都安装尾气净化装置(净化处理过程如图)。下列有关叙述,错误的是
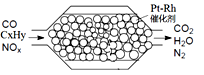
| A.尾气造成“雾霾”与汽油未充分燃烧有关 |
| B.尾气处理过程,氮氧化物(NOX)被还原 |
| C.Pt-Rh催化剂可提高尾气净化反应的平衡转化率 |
| D.使用氢氧燃料电池作汽车动力能有效控制雾霾 |
题号:3138807
题型:选择题
难易度:较易
日期:2016-05-11
来源:2016届福建省龙岩市高中毕业班3月质量检查理综化学试卷(带解析)
【题文】Si、SiO
2广泛用于制造晶体管、光导纤维等。下列有关说法正确的是
| A.附着油污的晶体管可用碱液浸泡 |
| B.光导纤维遇碱会影响光信号传输 |
| C.工业上用S iO2热分解法冶炼硅 |
| D.自然界中硅以游离态形式存在 |
题号:3138795
题型:实验题
难易度:较难
日期:2016-05-11
来源:2016届福建省龙岩市高中毕业班3月质量检查理综化学试卷(带解析)
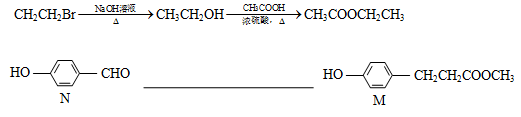
【题文】【化学——选修5有机化学基础】
有机物H是一种芳香酯,其合成路线如下图所示:
已知:
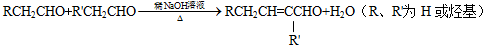
按要求回答下列问题:
(1)写出有机A的结构简式_________;C中含有的官能团__________(写名称)。
(2)E→ F的有机反应类型为__________。
(3)D与G反应生成H的化学方程式为_______________________________。
(4)C的同分异构体中,符合下列条件的共有________种(包括本身和顺反异构),
①能发生加聚反应 ②能发生银镜反应 ③属于芳香族化合物
其中核磁共振氢谱有五个吸收峰的同分异构体的结构简式_________________。
(5)有机物M是合成某种治疗心脏病药物的中间体,根据已有知识和相关信息,写出以N为原料制备M的合成路线流程图(其它无机、有机试剂任用)。合成路线流程图示例如下:
题号:3138800
题型:实验题
难易度:一般
日期:2016-05-11
来源:2016届福建省龙岩市高中毕业班3月质量检查理综化学试卷(带解析)
【题文】)FeCl
2是一种常用的还原剂。有关数据如下:
| C6H5Cl(氯苯)
| C6H4Cl2
| FeCl3
| FeCl2
|
溶解性
| 不溶于水,易溶于苯
| 不溶于C6H5Cl、C6H4Cl2、苯,易吸水。
|
熔点/℃
| -45
| 53
| ——
| ——
|
沸点/℃
| 132
| 173
| ——
| ——
|
实验室可以用多种方法来制备无水FeCl
2。回答下列问题:
I.按右图装置用H
2还原无水FeCl
3制取。
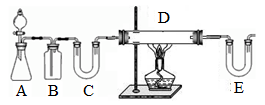
(1)装置C的作用是
;E中盛放的试剂是
;D中反应的化学方程式为
。
(2)温度控制不当,产品中含单质铁。检验产品中是否含铁方案是
。
II.按右下图装置,在三颈烧瓶中放入162.5g无水氯化铁和225g氯苯,控制反应温度在128~139℃加热3h,反应接近100%。冷却,分离提纯得到粗产品。反应如下:
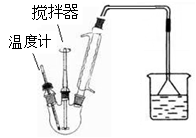
2FeCl
3+C
6H
5Cl→2FeCl
2+C
6H
4Cl
2+HCl
(3)该制取反应中,作还原剂的是
。
(4)反应温度接近或超过C
6H
5Cl的沸点,但实验过程中C
6H
5Cl并不会大量损失。原因是
。
(5)冷却实验装置,将三颈瓶内物质经过过滤、洗涤,干燥后,将得到粗产品。
①洗涤所用的试剂可以是
;
②回收滤液中C
6H
5Cl的方案是
。
(6)仅通过烧杯中的现象变化就可以监控氯化铁的转化率。若要监控氯化铁转化率达到或超过90%,则烧杯中加入的试剂可以是
。
题号:3138796
题型:填空题
难易度:较难
日期:2016-05-11
来源:2016届福建省龙岩市高中毕业班3月质量检查理综化学试卷(带解析)
【题文】【化学——选修3物质结构与性质】
I.一定条件下,O
2可通过得失电子转化为O
2-、O
2+和O
22-。
(1)从物质结构角度分析,四种含氧微粒氧化性由强到弱的顺序为
;理由是
。
II.已知:离子型配位化合物O
2[PtF
6]中铂元素为+5价,它可由PtF
6+O
2 = O
2[PtF
6]反应制得;PtF
6分子结构如图所示。
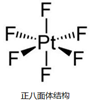
(2)O
2[PtF
6]中阳离子的电子式为
。
(3)PtF
6分子中Pt的杂化轨道类型是否为sp
3?答:______(填“是”或“否”),其原因是
。
(4)O
2[PtF
6]晶体具有的物理性质有
。(写2条)
Ⅲ.根据O
2、Xe的电离能,可推知Xe也能与PtF
6反应生成Xe[PtF
6]。
(5)已知,O
2、Xe的第一电离能分别为1175.7kJ·mol
-1和1175.5 kJ·mol
-1。试从电子得失角度推测Xe也能与PtF
6反应的原因:____________________。
(6)晶格能(
U)计算公式如下:
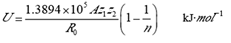
式中
R0为正、负离子的核间距(
R0≈r
++r
-),单位为pm;
z1、
z2分别为正负离子电荷数的绝对值,
A为常数。已知,Xe[PtF
6]、O
2[PtF
6]的晶格能
U1与
U2关系为
U2=
U1+41.84,且
n1=12,
n2=9。则两种晶体阳离子半径相对大小为________(用离子符号表示)。
题号:3138797
题型:填空题
难易度:困难
日期:2016-05-11
来源:2016届福建省龙岩市高中毕业班3月质量检查理综化学试卷(带解析)
【题文】【化学——选修2化学与技术】
由黄铜矿(主要成分是CuFeS
2)炼制精铜的工艺流 程示意图如下:
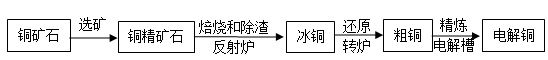
(1)在反射炉中,把铜精矿砂和石英砂混合加热到l000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物。
①该过程中两个主要反应的化学方程式分别是__________、__________;
②反射炉内生成炉渣的主要成分是__________。
(2)冰铜(Cu
2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu
2S被氧化为Cu
2O。生成的Cu
2O与Cu
2S反应,生成含Cu量约为98.5%的粗铜。
该过程发生反应的化学方程式分别是__________、__________。
(3)粗铜的电解精炼如右图所示。
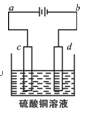
①在粗铜的电解过程中,粗铜板应是图中电极_____(填图中的字母);
②在电极d上发生的电极反应式为____________;
③若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为______。
题号:3138798
题型:填空题
难易度:较难
日期:2016-05-11
来源:2016届福建省龙岩市高中毕业班3月质量检查理综化学试卷(带解析)
【题文】碳是形成物种最多的元素之一,许多含碳物质对人类极其重要。

(1)石墨烯是一种由碳原子构成的单层片状结构的新材料,结构如右图所示。则12g石墨烯中含有
个6元环。
(2)工业上利用甲烷和氧气直接氧化制取甲醇的反应如下:
CH
4+
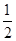
O
2(g) →CH
3OH(g) △H=-128.5kJ/mol
副反应有:
CH
4(g)+
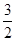
O
2(g) →CO(g)+2H
2O(g) △H="a" kJ/mol
CH
4(g)+2O
2(g) →CO
2(g)+2H
2O(g) △H="b" kJ/mol
CH
4(g)+O
2(g) → HCHO(g) +H
2O(g) △H="c" kJ/mol
①若要有利于甲醇的生成,除了改变温度外,还可以采取的两种措施是
;
②甲醇与氧气反应生成HCHO(g)和水蒸汽的热化学方程式为
。
(3)苯乙烷(C
8H
10)生产苯乙烯(C
8H
8)的反应:C
8H
10(g) →C
8H
8(g)+H
2(g) ΔH>0。T
1℃下,将0.40 mol苯乙烷充入2 L密闭容器中反应,不同时间容器内n(C
8H
10)如下表:
时间/min
| 0
| 10
| 20
| 30
|
n(C8H10)/mol
| 0.40
| 0.30
| 0.26
| n2
|
①当反应进行到30 min时恰好到达平衡,则n
2取值的最小范围是________;
②改变温度为T
2℃,其他条件不变,测得平衡时容器内气体压强为反应前的1.4倍,则此时苯乙烷的转化率为
。
(4)用惰性电极电解葡萄糖和硫酸钠混合溶,可以制得葡萄糖酸[CH
2OH(CHOH)
4COOH]和己六醇[CH
2OH(CHOH)
4CH
2OH]。葡萄糖酸在
极生成,对应的电极反应式
。
题号:3138799
题型:填空题
难易度:困难
日期:2016-05-11
来源:2016届福建省龙岩市高中毕业班3月质量检查理综化学试卷(带解析)
【题文】软锰矿主要成分为MnO
2,还含有CaCO
3、Fe
2O
3、Al
2O
3等杂质。工业上利用软锰矿制取碳酸锰(MnCO
3)流程如下:
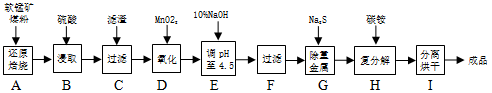
其中,还原焙烧主反应为:2MnO
2+C=2MnO+CO
2↑。根据要求回答问题:
(1)步骤D中Fe
2+被氧化,该反应的离子方程式为
。
(2)步骤H的离子方程式为
。
(3)加入Na
2S可以除去Pb
2+、Al
3+等离子。已知
Ksp(PbS)=1×10
-28 Ksp(MnS)= 1×10
-9.6,当溶液中
c(Pb
2+)=1×10
-5mol·L
-1时,溶液中
c(Mn
2+)允许的最大值为
。
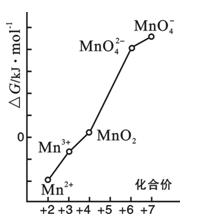
(4)pH=0的溶液中,不同价态锰的微粒的能量(△
G)如右图。若某种含锰微粒(如Mn
3+)的能量处于相邻价态两种微粒(Mn
2+和MnO
2)能量连线左上方,则该微粒不稳定并发生歧化反应,转化为相邻价态的微粒。
①MnO
42—能否稳定存在于pH=0的溶液中?答:______________(“能”或“不能”);
②将Mn
3+歧化反应设计为原电池,可测定反应平衡常数。电池负极反应为
,平衡常数表达式为
;
③实验室可利用以下反应检验Mn
2+存在:2Mn
2+ + 5S
2O
82- + 8H
2O → 16H
+ + 10SO
42- + 2MnO
4-确认Mn
2+存在的现象是
;检验时必须控制Mn
2+浓度和用量不能过大,否则实验失败。理由是
。


 按要求回答下列问题:
按要求回答下列问题:



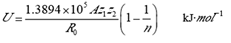



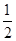 O2(g) →CH3OH(g) △H=-128.5kJ/mol
O2(g) →CH3OH(g) △H=-128.5kJ/mol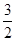 O2(g) →CO(g)+2H2O(g) △H="a" kJ/mol
O2(g) →CO(g)+2H2O(g) △H="a" kJ/mol
