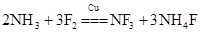适用年级:{{getGradeNameByProperty('高三|月考试卷|福建|2015年')}} 试卷类型:{{getTestPaperTypeName('高三|月考试卷|福建|2015年')}} 使用省份:{{getAreaName('高三|月考试卷|福建|2015年')}}
试卷年份:{{getYear('高三|月考试卷|福建|2015年')}}上传日期:2015-03-17题数:12
提示:单击题文可显示答案与解析。
题号:3213373
题型:选择题
难易度:一般
日期:2015-03-17
来源:【百强校】2014-2015福建省福州一中高三1月综合训练理综化学试卷(带解析)
【题文】工业上制备合成气的工艺主要是水蒸气重整甲烷:CH
4(g)+H
2O(g)

CO(g)+3H
2(g)△H>0,在一定条件下,向体积为1L的密闭容器中充入1mol CH
4(g)和1mol H
2O(g),测得H
2O(g)和H
2(g)的浓度随时间变化曲线如图所示,下列说法正确的是
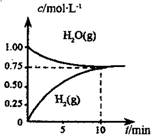
| A.达平衡时,CH4(g)的转化率为75% |
| B.0~10min内,v(CO)=0.075mol·L-1·min-1 |
| C.该反应的化学平衡常数K=O.1875 |
| D.当CH4(g)的消耗速率与H2(g)的消耗速率相等时,反应到达平衡 |
题号:3213374
题型:选择题
难易度:较难
日期:2015-03-17
来源:【百强校】2014-2015福建省福州一中高三1月综合训练理综化学试卷(带解析)
【题文】下列离子方程式正确的是
| A.Fe(OH)3与氢硫酸溶液混合:Fe(OH)3+3 H+ ="==" Fe3++3H2O |
| B.1mol·L-1的NaAlO2溶液和2.5mol·L-1的HCl等体积互相均匀混合:2AlO2-+5H+===Al(OH)3↓+Al3++ H2O |
| C.向硫酸铝按[NH4AL(SO4)2]溶液中滴加少量Ba(OH)2溶液:NH4++Al3++ 2SO42-+2Ba2++5OH-="==" AlO2-+2Ba SO4↓+NH3·H2O+2H2O |
| D.碳酸氢镁溶液中加入足量氢氧化钠:Mg2++2HCO3-+2OH-===MgCO3↓+2H2O+CO2↑ |
题号:3213375
题型:选择题
难易度:一般
日期:2015-03-17
来源:【百强校】2014-2015福建省福州一中高三1月综合训练理综化学试卷(带解析)
【题文】一定条件下,中学化学常见物质甲、乙之间存在如下转化关系,乙是
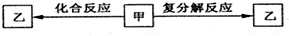
| A.HCl | B.NaHCO3 | C.KOH | D.FeCl2 |
题号:3213376
题型:选择题
难易度:一般
日期:2015-03-17
来源:【百强校】2014-2015福建省福州一中高三1月综合训练理综化学试卷(带解析)
【题文】某同学利用下图所示装置进行实验,一段时间后,水沿导管缓慢上升,下列说法正确的是
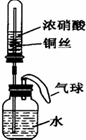
| A.实验过程中气球体积不会发生变化 |
| B.广口瓶内中液体的pH值增大 |
| C.广口瓶中有化合反应发生 |
| D.试管中不可能发生分解反应 |
题号:3213377
题型:选择题
难易度:一般
日期:2015-03-17
来源:【百强校】2014-2015福建省福州一中高三1月综合训练理综化学试卷(带解析)
【题文】往NH
4Cl溶液加入少量Na
2O固体,溶液中颗粒的数目不变的是
题号:3213378
题型:选择题
难易度:一般
日期:2015-03-17
来源:【百强校】2014-2015福建省福州一中高三1月综合训练理综化学试卷(带解析)
【题文】下列关于有机化合物的说法不正确的是
| A.乙烯和甲烷可用溴的四氯化碳溶液鉴别 |
| B.乙酸可与NaHCO3溶液反应生成CO2 |
| C.蛋白质和油脂在一定条件下都能水解 |
| D.葡萄糖和麦芽糖互为同系物 |
题号:3213379
题型:选择题
难易度:一般
日期:2015-03-17
来源:【百强校】2014-2015福建省福州一中高三1月综合训练理综化学试卷(带解析)
【题文】化学与社会、生产、生活紧切相关,下列说法正确的是
| A.医疗上可用硫酸钡作x射线透视肠胃的内服药,是因为硫酸钡不溶于水 |
| B.酸雨指25℃时pH值小于7的降水 |
| C.加碘食盐中添加碘酸钾而不用碘化钾,是因为碘酸钾能溶于水而碘化钾不溶于水 |
| D.发酵粉能使焙制出的糕点疏松多孔,是因为发酵粉中含有碳酸氢钠 |
题号:3213370
题型:实验题
难易度:困难
日期:2015-03-17
来源:【百强校】2014-2015福建省福州一中高三1月综合训练理综化学试卷(带解析)
【题文】(14分)实验室采用MgCl
2、AlCl
3的混合溶液与过量氨水反应制备MgAl
2O
4,主要流程如下
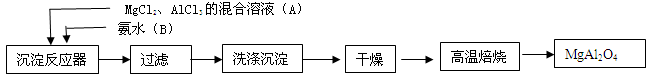
(1)为使Mg
2+、Al
3+同时生成沉淀,应先向沉淀反应器中加入
________(填“A”或“B”),再滴加另一反应物.
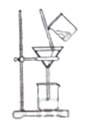
(2)如图所示,过滤操作中的一处错误是________________________.
(3)判断流程中沉淀是否洗净所采取的方法是____________________________________________.
(4)高温焙烧时,用于盛放固体的仪器名称是________________.
(5)无水AlCl
3(183°C升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备:
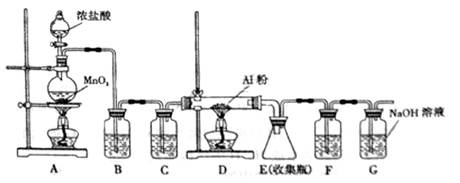
装置 B中盛放饱和NaCl溶液,该装置的主要作用是___________________.F中试剂的作用是_____________________.用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为_________________________.
题号:3213368
题型:填空题
难易度:困难
日期:2015-03-17
来源:【百强校】2014-2015福建省福州一中高三1月综合训练理综化学试卷(带解析)
【题文】[选考—有机化学基础](13分)
药用有机物A药用有机物A为一种无色液体,从A出发可发生如下一系列反应:
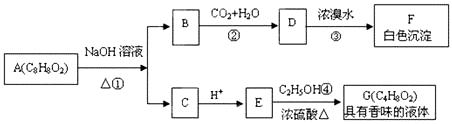
请回答:
(1)E中官能团的名称是___________;反应③的反应类型为
.
(2)化合物F结构简式:
.
(3)有机物A的同分异体甚多,其中属于酯类的化合物,且含有苯环结构的异构体有
种.
(4)E的一种同分异构体H,已知H可以和金属钠反应放出氢气,且在一定条件下可发生银镜反应,试写出H的结构简式:______________________________________.
(5)写出反应①的化学方程式:______________________________________.
题号:3213369
题型:填空题
难易度:较难
日期:2015-03-17
来源:【百强校】2014-2015福建省福州一中高三1月综合训练理综化学试卷(带解析)
【题文】[选考—物质结构与性质](13分)
三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工、太阳能电池和液晶显示器制造中得到广泛应用.NF
3是一种三角锥型分子,键角102°,沸点-129℃;可在铜的催化作用下由F
2和过量NH
3反应得到:
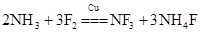
(1)上述化学方程式中的5种物质所含的化学键类型有
(填序号).
a.离子键 b.共价键 c.配位键 d.金属键
(2)与铜属于同一周期,且未成对价电子数最多的元素基态原子价电子排布式为
.
(3)NF
3的沸点比NH
3的沸点(-33℃)低得多的主要原因是_____________________.
(4)理论上HF、NaAlO
2和NaCl按6∶1∶2的物质的量之比恰好反应生成HCl、H
2O和一种微溶于水的重要原料,该物质含有三种元素,在金属铝的冶炼中有重要作用.该物质为配合物,其中心离子是______________,配位数为_______________.
(5)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol
-1),回答下面各题:

①在周期表中,最可能处于同一族的是
和
.
②T元素最可能是
(填“s”、“p”、“d”、“ds”等)区元素.若T为第二周期元素,F是第三周期元素中原子半径最小的元素,则T、F形成化合物的空间构型为
,其中心原子的杂化轨道类型为
.
题号:3213371
题型:填空题
难易度:困难
日期:2015-03-17
来源:【百强校】2014-2015福建省福州一中高三1月综合训练理综化学试卷(带解析)
【题文】(16分)辉铜矿是冶炼铜的重要原料.
(1)工业上冶炼粗铜的某种反应为:Cu
2S+O
2===2Cu+SO
2①当产生标况下11.2L气体时,转移电子数目为
;
②将粗铜进行电解精炼,粗铜应与外电源的
极相接;若精炼某种仅含杂质锌的粗铜,通电一段时间后测得阴极增重ag,电解质溶液增重bg,则粗铜中含锌的质量分数为
;
(2)将辉铜矿、软锰矿做如下处理,可以制得碱式碳酸铜:
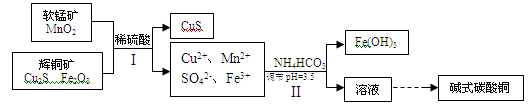
①步骤I中用稀硫酸浸取矿石,为提高浸取率可采取的措施有
(任写一种).
②步骤Ⅱ中调节浸出液pH=3.5的作用是
;
③步骤Ⅰ中发生如下3个反应,已知反应i)中生成的硫酸铁起催化作用。请写出反应iii)的化学方程式。
i)Fe
2O
3+3H
2SO
4 = Fe
2(SO
4)
3+3H
2O
ii)Cu
2S+ Fe
2(SO
4)
3 = CuSO
4+CuS+2FeSO
4iii)
④步骤Ⅱ中,碳酸氢铵参与反应的离子方程式为
.
题号:3213372
题型:填空题
难易度:较难
日期:2015-03-17
来源:【百强校】2014-2015福建省福州一中高三1月综合训练理综化学试卷(带解析)
【题文】(15分)X、Y、Z、W为原子序数依次增大的短周期元素.X、Y组成的气体甲能使湿润的红色石蕊试纸变蓝;X、Z处于同一主族,W的最外层电子数等于其电子层数.
(1)Y在元素周期表的位置是 .Z在氧气中燃烧的产物所含化学键类型有 .
(2)W元素的原子结构示意图是 .Z最高价氧化物的水化物与W的最高价氧化物的水化物,碱性较强的是 (填化学式).
(3)甲和Y的最高价氧化物的水化物反应生成乙.在0.1 mol·L-1乙溶液中,所含离子浓度由大到小的顺序是 .
(4)25℃时,W的最高价氧化物的水化物KSP=1.0×10-34,使含0.1 mol·L-1 W离子的溶液开始产生沉淀的pH为 .
(5)已知298K时:2Fe(s)+O2(g)="==" 2FeO(s) △H=-544.0kJ·mol-1
4W(s)+3 O2(g)===2W2O3(s) △H=-3351.4 kJ·mol-1
则W单质和FeO反应的热化学方程式为 .
 CO(g)+3H2(g)△H>0,在一定条件下,向体积为1L的密闭容器中充入1mol CH4(g)和1mol H2O(g),测得H2O(g)和H2(g)的浓度随时间变化曲线如图所示,下列说法正确的是
CO(g)+3H2(g)△H>0,在一定条件下,向体积为1L的密闭容器中充入1mol CH4(g)和1mol H2O(g),测得H2O(g)和H2(g)的浓度随时间变化曲线如图所示,下列说法正确的是