| A.m=n | B.m>n | C.m<n | D.无法判断 |
| A.向水中投入一小块金属钠 | B.将水加热煮沸 |
| C.向水中通入CO2 | D.向水中加入食盐晶体 |
A.x=10时,溶液中有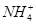 、 、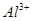 、 、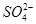 ,且 ,且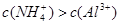 |
B.x=10时,溶液中有 、 、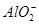 、 、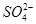 ,且 ,且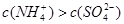 |
C.x=30时,溶液中有 、 、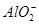 、 、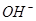 ,且 ,且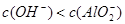 |
D.x=30时,溶液中有 、 、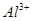 、 、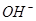 ,且 ,且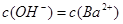 |
| A.在滴加酸碱指示剂酚酞试液后呈现红色的溶液中:Na+、Cl-、AlO2-、CO32- |
| B.在由水电离出的c(H+)=1×10-12mol/L的溶液中: HCO3-、Al3+、NH4+、ClO- |
| C.在c(H+)/c(OH-)=1×1012的溶液中:Fe2+、Mg2+、CO32-、NO3- |
| D.在AlCl3溶液中:K+、NO3-、S2-、Na+ |
| A.AgCl=AgI=Ag2S | B.AgCl<AgI< Ag2S |
| C.AgCl>AgI> Ag2S | D.AgI>AgCI> Ag2S |
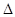 H=-67.7 kJ·mol-1
H=-67.7 kJ·mol-1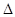 H=-57.3 kJ·mol-1
H=-57.3 kJ·mol-1A.氢氟酸的电离方程式及热效应可表示为:HF(aq) F-(aq)+H+(aq) F-(aq)+H+(aq) 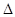 H=+10.4 kJ·mol-1 H=+10.4 kJ·mol-1 |
| B.当V=20时,溶液中:c(OH-)=c(HF)+c(H+) |
| C.当V=20时,溶液中:c(F-)<c(Na+)=0.1 mol·L-1 |
| D.当V>0时,溶液中一定存在:c(Na+)>c(F-)>c(OH-)>c(H+) |
| A.a=b | B.a>b | C.c (A-)= c(Na+) | D.c (A-)< c(Na+) |
 2PbSO4+2H2O。下列关于铅蓄电池的说法不正确的是( )
2PbSO4+2H2O。下列关于铅蓄电池的说法不正确的是( )| A.在放电时,该电池的负极材料是铅板 |
| B.在充电时,铅蓄电池的负极与充电器电源的负极相连 |
| C.在放电时,外电路中电流流向为:正极→外电路→负极 |
| D.在充电时,阳极发生的反应为:PbSO4+2e-===Pb+SO |
| A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
| B.由C(s,石墨)===C(s,金刚石) ΔH=+119 kJ·mol-1可知,金刚石比石墨稳定 |
| C.在稀溶液中:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的稀溶液混合,放出的热量大于57.3 kJ |
| D.在25 ℃、101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)===2H2O(l) ΔH=-285.8 kJ·mol-1 |
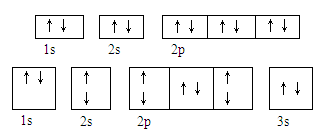
| A.①②③④ | B.只有①②③ | C.只有② | D.只有① |
| A.M层 | B.N 层 | C.O层 | D.P层 |
| A.1s、2p、3d、4s | B.1s、2s、3s、2p | C.2s、2p、3s、3p | D.4p、3d、4s、3p |
| A.化学平衡常数不随反应物或生成物的浓度的改变而改变 |
| B.化学平衡常数随温度的改变而改变 |
| C.对于一定温度下的同一个反应,其正反应和逆反应的化学平衡常数的乘积等于1 |
| D.温度越高,K值越大 |
| A.加入适量的6 mol·L-1的盐酸 | B.加入适量蒸馏水 |
| C.加入数滴氯化铜溶液 | D.加入适量的氯化钠溶液 |
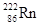 ,从而对人体产生伤害。该同位素原子的中子数和质子数之差是( )
,从而对人体产生伤害。该同位素原子的中子数和质子数之差是( )| A.136 | B.50 | C.86 | D.222 |
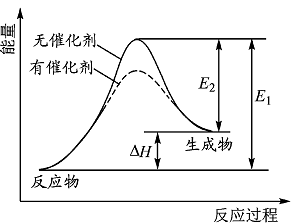
| A.该反应为放热反应 |
| B.催化剂能改变反应的焓变 |
| C.催化剂能降低反应的活化能 |
| D.逆反应的活化能大于正反应的活化能 |
| A.生铁中含有碳,抗腐蚀能力比纯铁弱 | B.用锡焊接的铁质器件,焊接处易生锈 |
| C.在铁制品上镀铜时,铁为阳极,铜盐为电镀液 | D.铁管上镶嵌锌块,铁管不易被腐蚀 |
| A.1∶2∶3 | B.3∶2∶1 | C.6∶3∶1 | D.6∶3∶2 |
 2HI(g),在温度T1和T2时,产物的量与反应时间的关系如图所示。符合图示的正确判断是( )
2HI(g),在温度T1和T2时,产物的量与反应时间的关系如图所示。符合图示的正确判断是( )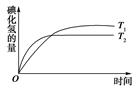
| A.T1>T2,ΔH>0 | B.T1>T2,ΔH<0 |
| C.T1<T2,ΔH>0 | D.T1<T2,ΔH<0 |
| A.中和pH与体积都相同的盐酸和硫酸,消耗NaOH的物质的量之比是1∶2 |
| B.pH=13的氨水加水稀释后,溶液中所有离子的浓度均降低 |
| C.浓度均为0.1 mol·L-1的下列溶液,pH由大到小排列顺序为:NaOH>Na2CO3>NaHSO4>(NH4)2SO4 |
| D.0.1 mol·L-1的硫酸铵溶液中,离子浓度大小顺序为: c(NH4+)>c(SO42-)>c(H+) >c(OH-) |
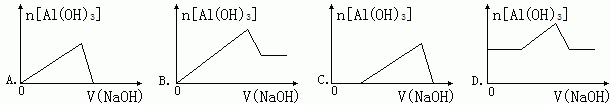
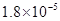 ,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=
,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=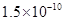
 mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示: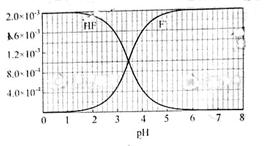

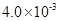 mol·L-1HF溶液与
mol·L-1HF溶液与 mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化), (填“有”或“无”)沉淀产生。
mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化), (填“有”或“无”)沉淀产生。| A.NH4Cl | B.NH4SCN | C.CH3COONH4 | D.NH4HCO3 |
 2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则前5分钟的平均反应速率v(N2)= 。平衡时H2的转化率为 。
2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则前5分钟的平均反应速率v(N2)= 。平衡时H2的转化率为 。 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:| T/℃ | 200 | 300 | 400 |
| K | K1 | K3 | 0.5 |
 N2(g)+3H2(g)的化学平衡常数为 。当测得NH3、N2和H2物质的量分别为3 mol、2 mol和 1 mol时,则该反应的v(N2)正 v(N2)逆(填“<”“>”或“=”)。
N2(g)+3H2(g)的化学平衡常数为 。当测得NH3、N2和H2物质的量分别为3 mol、2 mol和 1 mol时,则该反应的v(N2)正 v(N2)逆(填“<”“>”或“=”)。| | 甲 | 乙 | 丙 | 丁 |
| 化合物中各元素原子个数比 | A和C 1∶1 | B和A 1∶2 | D和E 1∶3 | B和E 1∶4 |