适用年级:{{getGradeNameByProperty('高二|月考试卷|福建|2011年')}} 试卷类型:{{getTestPaperTypeName('高二|月考试卷|福建|2011年')}} 使用省份:{{getAreaName('高二|月考试卷|福建|2011年')}}
试卷年份:{{getYear('高二|月考试卷|福建|2011年')}}上传日期:2011-04-14题数:20
提示:单击题文可显示答案与解析。
题号:3198592
题型:选择题
难易度:较易
日期:2015-08-12
来源:2010—2011学年福建省四地六校高二下学期第一次月考化学试卷
【题文】某元素原子价电子构型3d
54S
2,其应在
| A.第四周期ⅡA族 | B.第四周期ⅡB族 |
| C.第四周期ⅦA族 | D.第四周期ⅦB族 |
题号:4325787
题型:选择题
难易度:较易
日期:2013-04-15
来源:2010—2011学年福建省四地六校高二下学期第一次月考化学试卷
【题文】下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物是
| A.半导体材料砷化镓 | B.吸氢材料镧镍合金 |
| C.透明陶瓷材料硒化锌 | D.超导材K3C60 |
题号:4332510
题型:选择题
难易度:容易
日期:2012-08-21
来源:2010—2011学年福建省四地六校高二下学期第一次月考化学试卷
【题文】下列分子中的中心原子杂化轨道的类型相同的是
| A.CO2和SO2 | B.CH4和NH3 | C.BeCl2和BF3 | D.C2H4和C2H2 |
题号:4336992
题型:选择题
难易度:一般
日期:2012-05-03
来源:2010—2011学年福建省四地六校高二下学期第一次月考化学试卷
【题文】若将
15P原子的电子排布式写成1s
22s
22p
63s
23p
x23p
y1,它违背了( )
| A.能量守恒原理 | B.泡利原理 | C.能量最低原理 | D.洪特规则 |
题号:4337001
题型:选择题
难易度:较易
日期:2012-06-26
来源:2010—2011学年福建省四地六校高二下学期第一次月考化学试卷
【题文】已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
| A.X与Y形成化合物是,X可以显负价,Y显正价 |
| B.第一电离能可能Y小于X |
| C.最高价含氧酸的酸性:X对应的酸性弱于于Y对应的 |
| D.气态氢化物的稳定性:HmY小于HmX |
题号:4358750
题型:选择题
难易度:一般
日期:2011-04-14
来源:2010—2011学年福建省四地六校高二下学期第一次月考化学试卷
【题文】下列说法中正确的是
| A.3p2表示3p能级有两个轨道 |
| B.处于最低能量的原子叫基态原子 |
| C.同一原子中,1s、2p、4p电子能量逐渐降低 |
| D.同一原子中,2p.3p.4p能级的轨道数依次增多 |
题号:4358751
题型:选择题
难易度:一般
日期:2011-04-14
来源:2010—2011学年福建省四地六校高二下学期第一次月考化学试卷
【题文】某元素质量

数52,中子数28,其基态原子未成对电子数为
| A.3 | B.4  | C.5 | D.6 |
题号:4358752
题型:选择题
难易度:一般
日期:2011-04-14
来源:2010—2011学年福建省四地六校高二下学期第一次月考化学试卷
题号:4358753
题型:选择题
难易度:一般
日期:2011-04-14
来源:2010—2011学年福建省四地六校高二下学期第一次月考化学试卷
【题文】下列各组元素按第一电离能增加顺序排列的是( )
A.Na、Al、Mg B.Be、 B、Li C.Li、Na、K D.O、F、N
题号:4358754
题型:选择题
难易度:一般
日期:2011-04-14
来源:2010—2011学年福建省四地六校高二下学期第一次月考化学试卷
【题文】下列说法中,正确的是
| A.乙醇分子中含有6个极性键 |
| B.乙烯分子中不含非极性键 |
| C.电子云表示电子在核外单位体积的空间出现的机会多少 |
| D.苯分子是单键和双键交替的结构 |
题号:4358755
题型:选择题
难易度:一般
日期:2012-05-18
来源:2010—2011学年福建省四地六校高二下学期第一次月考化学试卷
【题文】下列各组物质中,化学键类型完全相同的是
| A.MgBr2和KCl | B.Cl2和HCl | C.HI和NaI | D.Na2O2和H2O2 |
题号:4358756
题型:选择题
难易度:一般
日期:2011-04-14
来源:2010—2011学年福建省四地六校高二下学期第一次月考化学试卷
【题文】下列说法中错误的是
| A.键长愈长,化学键愈不牢固 |
| B.元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 |
| C.除氦外的稀有气体原子的最外层电子数都是8 |
| D.原子及其离子的核外电子层数均等于该元素所在的周期数 |
题号:4358761
题型:选择题
难易度:一般
日期:2011-04-14
来源:2010—2011学年福建省四地六校高二下学期第一次月考化学试卷
题号:4358763
题型:选择题
难易度:一般
日期:2011-04-14
来源:2010—2011学年福建省四地六校高二下学期第一次月考化学试卷
【题文】下列分子中所有原子都满足最外层8电子稳定结构的是
题号:4358764
题型:选择题
难易度:一般
日期:2011-04-14
来源:2010—2011学年福建省四地六校高二下学期第一次月考化学试卷
【题文】x 、y为两种元素的原子,x的阴离子与y的阳离子具有相同的电子层结构,由此可知
| A.x的原子半径大于y的原子半径 |
| B.x的电负性大于y的电负性。 |
| C.x阴离子的半径小于y阳离子的半径 |
| D.x的第一电离能小于y 的第一电离能 |
题号:4358766
题型:选择题
难易度:一般
日期:2011-04-14
来源:2010—2011学年福建省四地六校高二下学期第一次月考化学试卷
【题文】短周期元素A、B、C原子序数依次递增,它们原子的最外层电子数之和为10,A与C同主族,B原子最外层电子数等于A原子次外层电子数,则下列叙述正确

的是
A.原子半径A<B<C
B.A的氢化物的稳定性大于C的氢化物
C.A的氧化物是离子化合物,B的氧化物是共价化合物
D.A与C可形成离子化合物
题号:4358758
题型:填空题
难易度:一般
日期:2011-04-14
来源:2010—2011学年福建省四地六校高二下学期第一次月考化学试卷
【题文】(12分)按要求填空
(1)在第二周期中(稀有气体除外),第一电离能最大的元素的原子结构示意

图是
,第一电离能最小的元素的原子轨道表达式_______________________。
(2)第四周期元素中,4p轨道半充满的元素是_____________(填元素符号)
价电子层中s电子数与d电子数相同的元素是
(填元素名称)。
(3)中国古代四大发明之一――黑火药,它的爆炸反应方程式为:
2KNO
3+3C+S
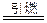
A+N
2↑+3CO
2↑(已配平)
①除K、S外,上述方程式中出现的元素形成氢化物的稳定性从大到小依次为_____。
②写出K的基态电子排布式_____________________

_________________
题号:4358759
题型:填空题
难易度:一般
日期:2011-04-14
来源:2010—2011学年福建省四地六校高二下学期第一次月考化学试卷
【题文】(14分)请回答下列问题:
(1)下列现象和应用与电子跃迁无关的是________________________________。
A.激光 B.焰色反应 C.燃烧放热 D.原子光谱 E.石墨导电
(2)A、B两种短周期元素,A是原子半径最小的元素,B原子最外层电子数是次外层的两倍。某平面正六边形分子由A、B两种元素组成且原子个数比为1:1,该分子中含有_______个σ键。
(3)元素铬化合物(CrO
2Cl
2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。
①与铬同周期的基态原子中最外层电子数与铬原子相同的元素有______(填元素符号),
②在a:苯 b:CH
3OH c:HCHO d:CS
2 e:CCl
4 五种有机溶剂中,碳原子采取sp
3杂化的分子有___________(填字母),CS
2
分子的键角是__________。
③过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,为d
0或d
10排布时,无颜色;为d
1~d
9排布时,有颜色,如

[Co(H
2O)
6]
2+显粉红色。其中Co
2+的价电子排布式为________________________
(4)利用CO可以合成化工原料COCl
2,其中
①COCl
2分子的结构式为
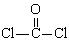
,②COCl
2分子内含有
(填标号);
A.4个σ键 B.2个σ键、2个π键
C.2个σ键、1个π键 D.3个σ键、1个π键
题号:4358760
题型:填空题
难易度:一般
日期:2011-04-14
来源:2010—2011学年福建省四地六校高二下学期第一次月考化学试卷
【题文】(12分)图表法、图象法是常用的科学研究方法。请回答以下问题
(1)第一电离能I
1是指气态原子X(g)失去一个电子成为气态阳离子X
+(g)所需的能量。下图是部分元素原子的第一电离能I
1随原子序数变化的曲线图。

① 将Na—Ar之间六种元素用短线连接起来(不必写在答题卷上),构成完整的图像。从上图分析可知,同一主族元素原子的第一电离能I
1变化规律是;__________________
_________________________________________________________________________
②上图折线中数字5代表元素在周期表中的位置是___________________________;
(2)已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出13种元素的X的数值:试结合元素周期律知识完成下列问题:
元素
| Al
| B
| Be
| C
| Cl
| F
| Li
|
X的数值
| 1.5
| 2.0
| 1.5
| 2.5
| 2.8
| 4.0
| 1.0
|
元素
| Mg
| Na
| O
| P
| S
| Si
|
|
X的数值
| 1.2
| 0.9
| 3.5
| 2.1
| 2.5
| 1.7
|
|
①经验规律告诉我们:

当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr
3中的化学键类型是____________________(填离子键或共价键)。
②某有机化合物分子中含有S—N键,你认为该共用电子对偏向于____________原子(填元素符号)。
(3) 已知:波长为300nm的紫外光的光子所具有的能量约为399 kJ/mol。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因:
_______________________________________________________________。

题号:4358767
题型:填空题
难易度:一般
日期:2011-04-14
来源:2010—2011学年福建省四地六校高二下学期第一次月考化学试卷
【题文】(14分)下表为长式周期表的一部分,其中的编号代表对应的元素。
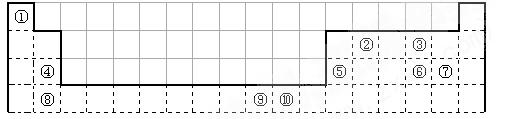
请回答下列问题:
(1)表中属于ds区的元素是
(填编号)。
(2)元素②与③形成的一种化合物是重要的化工原料,该化合物能使澄清石灰水变浑浊。有关该化合物分子的说法正确的是
。
| A.分子中含极性共价键 | B.属于非极性分子 |
| C.含有1个σ键和2个π键 | D.该化合物分子中,②原子采用sp2杂化 |
(3)根据上述表格

中的十种元素填空:
I、金属性最强的主族元素是_____________(填元素名称);
II、⑤、⑥、⑦的离子半径由小到大的顺序是_______________________(填化学式)
III、⑥、⑦两种元素的最高价氧化物对应的水化物的酸性由大到小的顺序是

_________
(填化学式),
(4)某元素的特征电子排布式为ns
nnp
n+1,该元素原子的核外最外层电子的孤对电子数为
_____________;该元素与元素①形成的分子X的空间构型为
。
 数52,中子数28,其基态原子未成对电子数为
数52,中子数28,其基态原子未成对电子数为

 的是
的是 图是 ,第一电离能最小的元素的原子轨道表达式_______________________。
图是 ,第一电离能最小的元素的原子轨道表达式_______________________。 A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平) _________________
_________________ 分子的键角是__________。
分子的键角是__________。 [Co(H2O)6]2+显粉红色。其中Co2+的价电子排布式为________________________
[Co(H2O)6]2+显粉红色。其中Co2+的价电子排布式为________________________ ,②COCl2分子内含有 (填标号);
,②COCl2分子内含有 (填标号);
 当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中的化学键类型是____________________(填离子键或共价键)。
当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中的化学键类型是____________________(填离子键或共价键)。


 中的十种元素填空:
中的十种元素填空: _________
_________