适用年级:{{getGradeNameByProperty('高二|月考试卷|福建|2010年')}} 试卷类型:{{getTestPaperTypeName('高二|月考试卷|福建|2010年')}} 使用省份:{{getAreaName('高二|月考试卷|福建|2010年')}}
试卷年份:{{getYear('高二|月考试卷|福建|2010年')}}上传日期:2010-05-27题数:23
提示:单击题文可显示答案与解析。
题号:3735224
题型:选择题
难易度:一般
日期:2011-04-01
来源:2010年福建省四地六校高二下学期第二次联考化学试题
【题文】最近,意大利科学家使用普通氧分子和带正电荷的氧离子制造出了由4个氧原子构成的氧分子,并用质谱仪探测到了它存在的证据。若该氧分子具有空间对称结构,下列关于该氧分子的说法正确的是
| A.是一种新的氧化物 | B.不可能含有极性键 |
| C.是氧元素的一种同位素 | D.是臭氧的同分异构体 |
题号:4383070
题型:选择题
难易度:容易
日期:2010-05-27
来源:2010年福建省四地六校高二下学期第二次联考化学试题
【题文】下列物质的性质与氢键无关的是( )
| A.冰的密度比水的密度小 | B.氨气极易溶于水 |
| C.SbH3的沸点比PH3高 | D.溶解度:邻-羟基苯甲醛 < 对-羟基苯甲醛 |
题号:4383071
题型:选择题
难易度:容易
日期:2010-05-27
来源:2010年福建省四地六校高二下学期第二次联考化学试题
【题文】有四种氯化物,它们的通式为XCl
2,其中最可能是第IIA族元素的氯化物是()
| A.白色固体,熔点低,完全溶于水,得到一种无色中性溶液,此溶液导电性差 |
| B.绿色固体,熔点高,易被氧化,得到一种蓝绿色溶液,此溶液具有良好的导电性 |
| C.白色固体,极易升华,如与水接触,可慢慢分解 |
| D.白色固体,熔点较高,易溶于水,得无色中性溶液,此溶液具有良好的导电性 |
题号:4383072
题型:选择题
难易度:容易
日期:2012-12-18
来源:2010年福建省四地六校高二下学期第二次联考化学试题
【题文】下列叙述中正确的是:( )
| A.原子晶体中,共价键的键能越大,熔沸点越高 |
| B.分子晶体中,分子间的作用力越大,该分子越稳定 |
| C.分子晶体中,共价键的键能越大,熔沸点越高 |
| D.某晶体溶于水后,可电离出自由移动的离子,该晶体一定是离子晶体 |
题号:4383073
题型:选择题
难易度:容易
日期:2010-05-27
来源:2010年福建省四地六校高二下学期第二次联考化学试题
【题文】已知A、B元素同周期,且电负性A<B,下列说法正确的是 ( )
A. A与B形成化合物时,A显正价,B显负价且A原子的半径小于B原子的半径
B. A与B形成的共价化合物分子一定是极性分子
C. 气态氢化物的稳定性:HmB小于HnA
D. 最高价含氧酸的酸性:A对应的酸性弱于B对应的酸性
题号:4383074
题型:选择题
难易度:容易
日期:2013-07-23
来源:2010年福建省四地六校高二下学期第二次联考化学试题
【题文】下列关于配位化合物的叙述中,不正确的是( )
| A.配位化合物中必定存在配位键 |
| B.配位化合物中只有配位键 |
| C.[Cu(H2O)6]2+中的Cu2+提供空轨道,H2O中的氧原子提供孤对电子形成配位键 |
| D.配位化合物在半导体等尖端技术、医学科学、催化反应和材料化学等领域都有着广泛的应用 |
题号:4383075
题型:选择题
难易度:容易
日期:2012-08-31
来源:2010年福建省四地六校高二下学期第二次联考化学试题
【题文】下列关于砷(As)元素的叙述中,不正确的是( )
| A.在AsCl3分子中,砷原子最外层电子数为8 | B.Na3AsO4溶液的pH大于7 |
| C.砷的氢化物的化学式为AsH3,它是一种强氧化剂 |
| D.砷的相对原子质量为74.92,由此可知砷原子核内约有42个中子 |
题号:4383076
题型:选择题
难易度:容易
日期:2010-05-27
来源:2010年福建省四地六校高二下学期第二次联考化学试题
【题文】A、B都是短周期元素,原子半径B>A,它们可形成化合物AB2,由此可以得出的正确判断是()
A. 原子序数:A>B B. A和B可能在同一主族
C. A可能在第二周期ⅣA族 D. A肯定是金属元素
题号:4383080
题型:选择题
难易度:容易
日期:2010-05-27
来源:2010年福建省四地六校高二下学期第二次联考化学试题
【题文】已知C
3N
4晶体很可能具有比金刚石更大的硬度,且原子间以单键结合。下列关于C
3N
4晶体的说法中正确的是( )
| A.C3N4晶体是分子晶体 |
| B.C3N4晶体中,C-N键的键长比金刚石中的C-C键的键长要长 |
| C.C3N4晶体中每个C原子连接4个N原子,而每个N原子连接3个C原子 |
| D.C3N4晶体中微粒间通过离子键结合 |
题号:4383081
题型:选择题
难易度:容易
日期:2010-05-27
来源:2010年福建省四地六校高二下学期第二次联考化学试题
【题文】下面有关晶体的叙述中,不正确的是( )
| A.金刚石空间网状结构中,由共价键形成的碳原子环中,最小环上有6个碳原子 |
| B.氯化钠晶体中,每个Na+周围距离相等的Cl-共有6个 |
C.氯化铯晶体中,每个CS+周围紧邻8个 Cl- Cl- |
D.干冰晶体中,每个CO2分子周围紧邻10个C O2分子 O2分子 |
题号:4383082
题型:选择题
难易度:容易
日期:2010-05-27
来源:2010年福建省四地六校高二下学期第二次联考化学试题
【题文】有下列离子晶体的空间结构示意图。图中●和化学式中M分别代表阳离子,图中○和化学式中N分别代表阴离子,则化学式为MN
2的晶体结构为( )
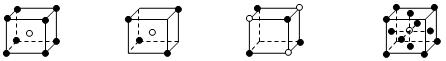
A B C D
题号:4383083
题型:选择题
难易度:容易
日期:2010-05-27
来源:2010年福建省四地六校高二下学期第二次联考化学试题
【题文】元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )
| A.同一元素不可能既表现金属性,又表现非金属性 |
| B.第三周期元素的最高正化合价等于它所处的主族序数 |
| C.短周期元素形成离子后,最外层电子都达到8电子稳定结构 |
| D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同 |
题号:4383084
题型:选择题
难易度:容易
日期:2010-05-27
来源:2010年福建省四地六校高二下学期第二次联考化学试题
【题文】居室装修用石材的放射性常用
22688Ra作为标准,居里夫人(Marie Curie)因对Ra元素的研究两度获得诺贝尔奖。下列叙述中正确的是( )
| A.RaCl2的熔点比CaCl2高 | B.Ra元素位于元素周期表中第六周期ⅡA族 |
| C.一个22688Ra原子中含有138个中子 | D.Ra(OH)2是一种两性氢氧化物 |
题号:4383085
题型:选择题
难易度:容易
日期:2010-05-27
来源:2010年福建省四地六校高二下学期第二次联考化学试题
【题文】下列离子中,电子数大于质子数且质子数大于中子数的是( )
题号:4383086
题型:选择题
难易度:容易
日期:2010-05-27
来源:2010年福建省四地六校高二下学期第二次联考化学试题
【题文】下表是元素周期表的一部分,有关说法正确的是( )

| A.e的氢化物比d的氢化物稳定 |
| B.a、b、e三种元素的原子半径:e>b>a |
| C.六种元素中,c元素单质的化学性质最活泼[来源:学.科.网Z.X.X.K] |
| D.c、e、f的最高价氧化物对应的水化物的酸性依次增强 |
题号:4383087
题型:选择题
难易度:容易
日期:2010-05-27
来源:2010年福建省四地六校高二下学期第二次联考化学试题
【题文】等物质的量的主族金属A、B、C分别与足量的稀盐酸反应,所得氢气的体积依次为V
A、V
B、V
C,已知V
B=2V
 C
C,V
A=V
B+V
C,则在C的生成物中,该金属元素的化合价为( )

A.+1 B.+2 C.+3 D.+4
题号:4383088
题型:选择题
难易度:容易
日期:2010-05-27
来源:2010年福建省四地六校高二下学期第二次联考化学试题
【题文】X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻。X的核电荷数是Y是核外电子数的一半,Y与M可形成化合物
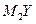
。下列说法正确的是( )
| A.还原性:X的氧化物>Y的氧化物>Z的氢化物 |
| B.简单离子的半径:M的离子>Z的离子>Y的离子>X的离子 |
C.YX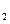 M M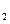 Y都是含有极性键的极性分子 Y都是含有极性键的极性分子 |
| D.Z元素的最高价氧化物的水化物的化学式为HZO4 |
题号:4383089
题型:选择题
难易度:容易
日期:2010-05-27
来源:2010年福建省四地六校高二下学期第二次联考化学试题
【题文】由短周期元素组成的中学常见无机物A、B、C、D、E、X,存在如在右图转化关系(部分生成物和反应条件略去)下列推断不正确的是( )
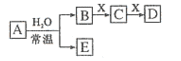
A.若X是
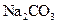
,C为含极性键的非极性分子,则A一定是氯气,且D和E不反应
B.若A是单质,B和D的反应是
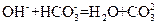
,则E一定能还原
C.若D为CO,C能和E反应,则A一定为
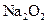
,其电子式是
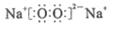
D.若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
题号:4383077
题型:填空题
难易度:容易
日期:2010-05-27
来源:2010年福建省四地六校高二下学期第二次联考化学试题
【题文】(12分)化合物YX2、ZX2中,X、Y、Z的核电荷数小于18;X原子最外层的p能级中有一个轨道充填了2个电子,Y原子的最外层中p能级的电子数等于前一层电子总数,且X和Y具有相同的电子层数;Z与X在周期表中位于同一主族。回答下列问题:K^S*5U.C#O
(1)Y的价电子轨道表示式为 ;
(2)YX2的电子式是 ,分子构型为 ,中心原子发生了____杂化。
(3)Y与Z形成的化合物的分子式是_______,该化合物中化学键是________键(填“极性”或“非极性”),该分子属于__________分子(填“极性”或“非极性”)。[来源:Z*xx*k.Com]
(4)Y的氢化物中分子构型为正四面体的是__ _____(填名称),键角为_______,中心原子的杂化形式为_______。
(5)元素X与Y的电负性的大小关系是___________(用元素符号填写,并填﹥、﹤、﹦),
X与Z的第一电离能的大小关系是___________。(用元素符号填写,并填﹥、﹤、﹦)
题号:4383078
题型:填空题
难易度:容易
日期:2010-05-27
来源:2010年福建省四地六校高二下学期第二次联考化学试题
【题文】(6分)氮是地球上

极为丰富的元素。
K^S*5U.C#O(1)N
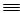
N的键能为942 kJ·mol
-1,N-N单键的键能为247 kJ·mol
-1,计算说明N
2中的___________键比____________键稳定(填“σ”或“π”)。
(2)(CH
3)
3NH
+和AlCl
4-可形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂__________(填“大”或“小”),可用作__________(填代号)。
a.助燃剂 b.“绿色”溶剂
c.复合材料 d.绝热材料
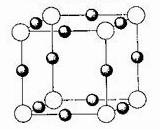
(3)X
+中所有电子正好充满K、L、M三个电子层,它与N
3-形成的晶体结构如图所示。X的元素符号是_____________,与同一个N
3-相连的X
+有__________个

(白圆圈代表N
3-离子)
题号:4383079
题型:填空题
难易度:容易
日期:2010-05-27
来源:2010年福建省四地六校高二下学期第二次联考化学试题
【题文】(14分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
K^S*5U.C#O族
周期
| IA
|
| 0
|
1
| ①
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
|
|
2
|
|
|
| ②
| ③
| ④
|
|
|
3
| ⑤
|
| ⑥
| ⑦
|
|
| ⑧
|
|
(1)④、⑤、⑥的原子半径由大到小的顺序为_________________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_________________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________

(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
a.MnO
2 b.FeCl
3 c.Na
2SO
3 d.KMnO
4(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
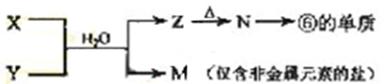
X溶液与Y溶液反应的离子方程式为_____________________,
N→⑥的单质的化学方程式为________________。
K^S*5U.C#O常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至_________________。
题号:4383090
题型:填空题
难易度:容易
日期:2010-05-27
来源:2010年福建省四地六校高二下学期第二次联考化学试题
【题文】(8分)研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题。
(1)C、Si、N元素的电负性由大到小的顺序是
。C
60和金刚石都是碳的同素异形体,金刚石熔点高于C
60熔点,原因是
。
K^S*5U.C#O(2)A、B均为短周期金属元素。依据下表数据和已学知识,
电离能/KJ·mol-1
| I1
| I2
| I3
| I4
|
A
| 932
| 1821
| 15390
| 21771
|
B
| 738
| 1451
| 7733
| 10540
|
写出B原子的电子排布式:
。
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,为d
0或d
10排布时,无颜色;为d
1~d
9排布时,有颜色,如[Co(H
2O)
6]
2+显粉红色。据此判断,[Mn(H
2O)
6]]
2+ (填“无”或“有”)颜色。
(4)利用CO可以合成化工原料COCl
2、络合物Fe(CO)
5等。
①已知COCl
2分子的结构式为
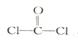
,则 COCl
2分子内含
_______(填标号)。
A.4个
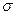
键
B.2个
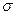
键、2个
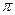
键
C.2个
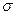
键、1个
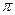
键
D.3个
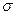
键、1个
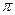
键
②Fe(CO

)
5在一定条件下发生分解反应:Fe(CO)
5=Fe(s)+5CO,反应过程中,断裂的化学

键只有配位键,形成的化学键是
。
题号:4383091
题型:填空题
难易度:容易
日期:2010-05-27
来源:2010年福建省四地六校高二下学期第二次联考化学试题
【题文】(15分)已知周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水化物是强酸。回答下列问题:
(1)W与Q可以形成一种高温结构陶瓷材料。W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是
;
(2)Q的具有相同化合价且可以相互转变的氧化物是
;
(3)R和Y形成的二元化合

物中,R呈现最高化合价的化合物的化学式是
;
(4)这5个元素的氢化物分子中,① 立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式)
,其原因是

;
②电子总数相同的氢化物的化学式和立体结构分别是
;
(5)W和Q所形成的结构陶瓷材料的一

种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH
2)
4和HCl气体;W(QH
2)
4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是
。
 Cl-
Cl- O2分子
O2分子

 C,VA=VB+VC,则在C的生成物中,该金属元素的化合价为( )
C,VA=VB+VC,则在C的生成物中,该金属元素的化合价为( ) A.+1 B.+2 C.+3 D.+4
A.+1 B.+2 C.+3 D.+4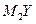 。下列说法正确的是( )
。下列说法正确的是( ) M
M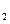 Y都是含有极性键的极性分子
Y都是含有极性键的极性分子
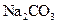 ,C为含极性键的非极性分子,则A一定是氯气,且D和E不反应
,C为含极性键的非极性分子,则A一定是氯气,且D和E不反应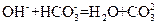 ,则E一定能还原
,则E一定能还原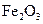
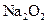 ,其电子式是
,其电子式是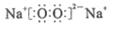
 极为丰富的元素。K^S*5U.C#O
极为丰富的元素。K^S*5U.C#O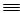 N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-1,计算说明N2中的___________键比____________键稳定(填“σ”或“π”)。
N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-1,计算说明N2中的___________键比____________键稳定(填“σ”或“π”)。 (白圆圈代表N3-离子)
(白圆圈代表N3-离子)

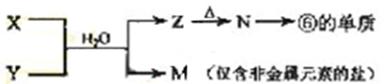
 ,则 COCl2分子内含_______(填标号)。
,则 COCl2分子内含_______(填标号)。 键
键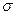 键、2个
键、2个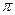 键
键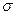 键、1个
键、1个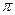 键
键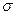 键、1个
键、1个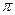 键
键 )5在一定条件下发生分解反应:Fe(CO)5=Fe(s)+5CO,反应过程中,断裂的化学
)5在一定条件下发生分解反应:Fe(CO)5=Fe(s)+5CO,反应过程中,断裂的化学 键只有配位键,形成的化学键是 。
键只有配位键,形成的化学键是 。 物中,R呈现最高化合价的化合物的化学式是 ;
物中,R呈现最高化合价的化合物的化学式是 ;
 种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCl气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是 。
种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCl气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是 。