 =1×10-10,下列叙述正确的是
=1×10-10,下列叙述正确的是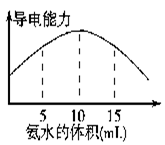
| A.0.5% | B.1.5% | C.0.1% | D.1% |
| A.1∶9 | B.1∶1 | C.1∶2 | D.1∶4 |
| A.溶液的pH:a<b<c<d |
| B.溶液的导电能力:a>b>d>c |
| C.c、d溶液呈碱性 |
| D.a、b溶液呈酸性 |
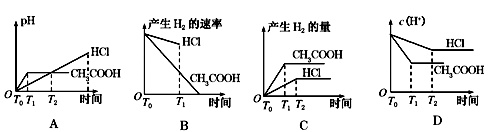
| A.13 | B.12 | C.11 | D.10 |
| A.4 | B.7.2 | C.10 | D.11.3 |
| A.常温下,pH值等于14与pH值等于12的两种NaOH溶液等体积混和后,c(H+)=(10-14+10-10)/2 |
| B.常温下,浓度为1×10-10mol/L的KOH溶液的pH值最接近于4 |
| C.氨水加水稀释,溶液中除水以外的所有粒子的浓度都减小 |
| D.常温下,相同温度下pH值等于1的盐酸溶液中水的电离程度与pH值等于13的Ba(OH)2溶液中水的电离程度相等 |
| A.②④⑥ | B.①② | C.②③⑤ | D.②④⑤⑥ |
| A.a>b=c | B.c>b>a | C.a>c>b | D.b>c>a |
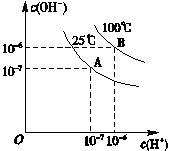
| A.100 ℃时,pH=12的NaOH溶液和pH=2的H2SO4溶液等体积混合时恰好中和,所得溶液的pH等于7 |
| B.25 ℃时,0.2 mol/L Ba(OH)2溶液和0.2 mol/L HCl溶液等体积混合,所得溶液的pH等于7 |
| C.25 ℃时,0.2 mol/L NaOH溶液与0.2 mol/L醋酸等体积混合后恰好中和,所得溶液pH等于7 |
| D.25 ℃时,pH=12的氨水和pH=2的H2SO4溶液等体积混合,所得溶液的pH大于7 |
| A.11:1 | B.9:1 | C.1:11 | D.1:9 |
| A.自来水 | B.0.5 mol·L-1的盐酸 |
| C.0.5 mol·L-1的CH3COOH溶液 | D.0.5 mol·L-1的KCl溶液 |
| 酸 | HClO4 | H2SO4 | HCl | HNO3 |
| Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
| A.Al3+ Na+NO3- Cl- | B.K+ Na+Cl- NO3- |
| C.K+ Na+ Cl-AlO2- | D.K+ NH4+SO42-NO3- |

 NH4+ + OH- 。对于该平衡,下列叙述中正确的是
NH4+ + OH- 。对于该平衡,下列叙述中正确的是| A.加入水时,溶液中c(OH-) / c(NH3·H2O) 增大 |
| B.加入少量NaOH固体,平衡向逆反应方向移动,电离平衡常数减小 |
| C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(OH-)增大 |
| D.降低温度,溶液中c(NH4+)增大 |
| A.溶液中pH醋酸比盐酸大 |
| B.与足量的锌粉反应产生的氢气体积相同 |
| C.与足量锌粒反应时,一开始盐酸的速率快 |
| D.能中和NaOH溶液的物质的量醋酸较少 |
| A.醋酸 | B.硫酸 | C.硝酸 | D.盐酸 |
| A.在相同条件下,甲酸的导电性比强酸溶液的导电性弱 |
| B.甲酸能与水以任意比互溶 |
| C.10mL 1mol/L甲酸恰好跟10 mL 1mol/L NaOH溶液完全反应 |
| D.1mol/L甲酸溶液中c(H+)约为1×10-2mol/L |
| A.醋酸的浓度达到1 mol·L-1 |
| B.H+的浓度达到0.5 mol·L-1 |
| C.醋酸分子的浓度、醋酸根离子的浓度、H+的浓度均为0.5 mol·L-1 |
| D.醋酸分子电离成离子的速率和离子重新结合成醋酸分子的速率相等 |
A.NaHSO4 Na++H++SO42- Na++H++SO42- | B.HCO3-+H2O=== H3O++CO32- |
| C.HClO===H++ClO- | D.H2S H++HS- H++HS- |
| A.在熔融状态或溶于水能导电的物质叫电解质 |
| B.电解质在通电时发生电离 |
| C.熔融的KOH导电,所以KOH是电解质 |
| D.NaCl晶体不导电,所以NaCl不是电解质 |
| A.强电解质在水溶液中的电离过程是不可逆的 |
| B.强电解质的水溶液导电能力一定比弱电解质的水溶液导电能力强 |
| C.易溶于水的电解质一定是强电解质 |
| D.同一弱电解质溶液,温度不同时,导电能力相同 |
| 实验次 序编号 | 盐酸溶液体积 V/mL | 氢氧化钠溶液体积 V/mL |
| 1 | 19.90 | 10.00 |
| 2 | 20.10 | 10.00 |
| 3 | 22.00 | 10.00 |
| 4 | 20.00 | 10.00 |
| ① | HF | Ka=6.8×10-4 mol•L-1 |
| ② | CH3COOH | Ka=1.7×10-5 mol•L-1 |
| ③ | HCN | Ka=6.2×10-10 mol•L-1 |
| ④ | H2CO3 | Ka1=4.4×10-7mol•L-1 Ka2=4.7×10-11 mol•L-1 |
 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
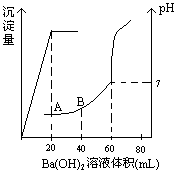
 氢氧化钡溶液时(忽略溶液体积的变化),生成沉淀的量和溶液的pH变化与加入氢氧化钡溶液液体积的关系如右图所示。求:
氢氧化钡溶液时(忽略溶液体积的变化),生成沉淀的量和溶液的pH变化与加入氢氧化钡溶液液体积的关系如右图所示。求: