【题文】(15分)节日期间因燃放鞭炮会引起空气中SO
2含量增高,造成大气污染。实验小组同学欲测定空气中SO
2的含量,并探究SO
2的性质。
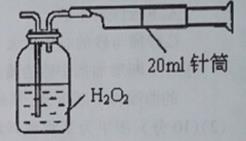
I.某实验小组同学拟用下图所示简易装置测定空气中SO
2的含量。
实验操作如下:按图连接好仪器,检查装置气密性后,在广口瓶中盛放足量的H
2O
2水溶液,用规格为20mL的针筒抽气100次,使空气中的SO
2被H
2O
2水溶液充分吸收(SO
2+ H
2O
2=H
2S0
4)。在吸收后的水溶液中加入足量的BaCl
2溶液,生成白色沉淀,经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.233mg。
(1)计算所测空气中SO
2含量为_______mg·L
-1。
(2)已知常温下BaS0
3的Ksp为5.48x10
-7,饱和亚硫酸溶液中c(S0
32-)=6.3x10
-8{mol·L
-1。
有同学认为以上实验不必用H
2O
2吸收SO
2,直接用O.1mol·L
-1BaCl
2溶液来吸收S0
2即可产生沉淀。请用以上数据分析这样做是否可行________________.
U.另一实验小组同学依据SO
2具有还原性,推测SO
2能被C1
2氧化生成SO
2C1
2。
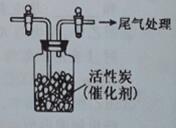
用如图所示装置收集满C1
2,再通入SO
2,集气瓶中立即产生无色液体,充分反应后,将液体和剩余气体分离,进行如下研究。
(3)写出二氧化锰和浓盐酸反应制取氯气的离子方程式____________________.
(4)研究反应的产物。向所得液体中加水,出现白雾,振荡、静置得到无色溶液。经检验该溶液中的阴离子(除OH
-外)只有S0
42-、C1
-,证明无色液体是SO
2C1
2。
写出SO
2C1
2与H
2O反应的化学方程式_______________________________________.
(5)研究反应进行的程度。用NaOH溶液吸收分离出的气体,用盐酸酸化后,再滴加BaCl
2溶液。产生白色沉淀。
①该白色沉淀的成分是_____________.
②SO
2和C1
2生成SO
2C1
2的反应________可逆反应(填“是”或“不是”),阐述理由___________.


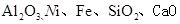 等)制备草酸镍晶体(NiC2O4·2H2O)的部分实验流程如下:
等)制备草酸镍晶体(NiC2O4·2H2O)的部分实验流程如下: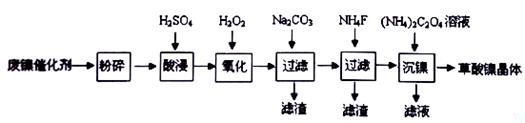
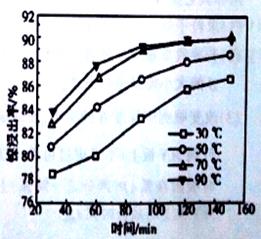

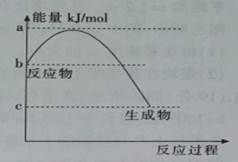
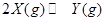 ,温度
,温度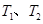
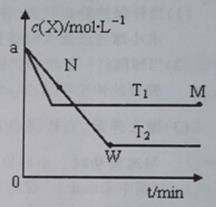
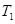 ___________
___________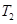 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。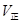 __________N点的逆反应速率
__________N点的逆反应速率 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。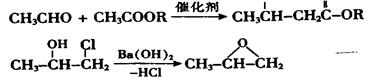
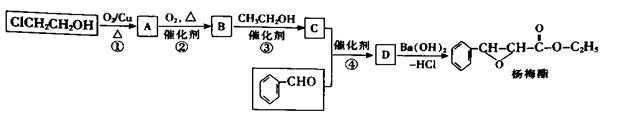
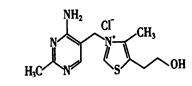
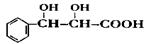 下列有关该物质的叙述中,正确的是________。
下列有关该物质的叙述中,正确的是________。