适用年级:{{getGradeNameByProperty('高二|月考试卷|福建|2015年')}} 试卷类型:{{getTestPaperTypeName('高二|月考试卷|福建|2015年')}} 使用省份:{{getAreaName('高二|月考试卷|福建|2015年')}}
试卷年份:{{getYear('高二|月考试卷|福建|2015年')}}上传日期:2015-05-21题数:25
提示:单击题文可显示答案与解析。
题号:3207847
题型:选择题
难易度:一般
日期:2015-05-21
来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(带解析)
【题文】从实验测得不同物质中氧氧之间的键长和键能的数据:
O—O键
数据
| O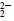
| O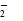
| O2
| O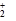
|
键长(10-12 m)
| 149
| 128
| 121
| 112
|
键能(kJ·mol-1)
| x
| y
| z=494
| w=628
|
其中x、y的键能数据尚未测定,但可根据规律性推导键能的大小顺序为w>z>y>x;该规律性是
A.成键的电子数越多,键能越大
B.键长越长,键能越小
C.成键所用的电子数越少,键能越大
D.成键时电子对越偏移,键能越大
题号:3207848
题型:选择题
难易度:一般
日期:2015-05-21
来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(带解析)
【题文】下列说法正确的是
| A.离子化合物中可能含有共价键,但不一定含有金属元素 |
| B.分子中一定含有共价键 |
| C.非极性分子中一定存在非极性键 |
| D.极性分子中一定不存在非极性键 |
题号:3207849
题型:选择题
难易度:一般
日期:2015-05-21
来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(带解析)
【题文】共价键是有饱和性和方向性的,下列有关叙述不正确的是
| A.共价键的饱和性是由成键原子的未成对电子数决定的 |
| B.共价键的方向性是由成键原子的轨道的方向性决定的 |
| C.共价键的饱和性决定了分子内部的原子的数量关系 |
| D.共价键的饱和性与原子轨道的重叠程度有关 |
题号:3207850
题型:选择题
难易度:一般
日期:2015-05-21
来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(带解析)
【题文】已知键能N≡N 946 kJ/mol ,H-H 436kJ/mol ,N-H 391 kJ/mol.从理论上计算2NH
3(g)
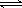
N
2(g)+3H
2(g)的⊿H为
| A.-46 kJ/mol | B.-92 kJ/mol |
| C.+92 kJ/mol | D.+1800kJ/mol |
题号:3207851
题型:选择题
难易度:一般
日期:2015-05-21
来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(带解析)
【题文】下列分子中的中心原子的杂化方式为sp杂化,分子的空间构型为直线形且分子中没有形成π键的是
题号:3207852
题型:选择题
难易度:较难
日期:2015-05-21
来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(带解析)
【题文】若ABn的中心原子A上没有未用于形成共价键的孤电子对,运用价层电子对互斥理论,判断下列说法中正确的是
| A.若n=2,则分子的立体结构为V形 |
| B.若n=3,则分子的立体结构为三角锥形 |
| C.若n=4,则分子的立体结构为正四面体形 |
| D.以上说法都不正确 |
题号:3207853
题型:选择题
难易度:一般
日期:2015-05-21
来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(带解析)
【题文】实验测得CO
2为共价化合物,两个C=O键间的夹角为180°,以下判断正确的是
| A.由极性键构成的极性分子 | B.由极性键构成的非极性分子 |
| C.由非极性键构成的极性分子 | D.CO2中C采取sp2杂化 |
题号:3207854
题型:选择题
难易度:一般
日期:2015-05-21
来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(带解析)
【题文】下列分子中所有原子都满足最外层8电子结构的是
①SF
6 ②PCl
5 ③PCl
3 ④CS
2 ⑤NO
2 ⑥N
2
题号:3207855
题型:选择题
难易度:较难
日期:2015-05-21
来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(带解析)
【题文】中学化学中很多“规律”都有其使用范围,下列根据有关“规律”推出的结论合理的是
| A.根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 |
| B.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 |
| C.根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性 |
| D.根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
题号:3207856
题型:选择题
难易度:较难
日期:2015-05-21
来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(带解析)
【题文】用价层电子对互斥理论预测H
2S和BF
3的立体结构,两个结论都正确的是
| A.直线形;三角锥形 | B.V形;三角锥形 |
| C.直线形;平面三角形 | D.V形;平面三角形 |
题号:3207857
题型:选择题
难易度:困难
日期:2015-05-21
来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(带解析)
【题文】图甲和图乙表示的是元素的某种性质随原子序数的变化。下列说法正确的是
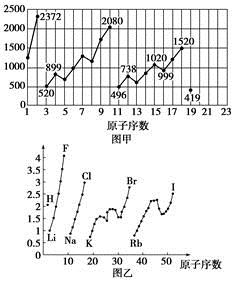
| A.图甲可能表示的是元素原子的第一电离能随原子序数的变化关系 |
| B.图甲可能表示的是元素单质的熔点随原子序数的变化关系 |
| C.图乙可能表示的是元素原子的半径随原子序数的变化关系 |
| D.图乙不可能表示同族元素的电负性随原子序数的变化关系 |
题号:3207858
题型:选择题
难易度:一般
日期:2015-05-21
来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(带解析)
【题文】下列轨道表示式能表示氮原子的最低能量状态的是
题号:3207859
题型:选择题
难易度:一般
日期:2015-05-21
来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(带解析)
【题文】已知某+2价离子的电子排布式为1s
22s
22p
63s
23p
63d
9,该元素在周期表中所属的族是
题号:3207860
题型:选择题
难易度:较难
日期:2015-05-21
来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(带解析)
【题文】下列有关多电子原子的叙述中,正确的是
| A.在一个多电子原子中,不可能有两个运动状态完全相同的电子 |
| B.在一个多电子原子中,不可能有两个能量相同的电子 |
| C.在一个多电子原子中,N层上的电子能量肯定比M层上的电子能量高 |
| D.某个多电子原子的3p能级上仅有两个电子,它们的自旋状态必然相反 |
题号:3207861
题型:选择题
难易度:一般
日期:2015-05-21
来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(带解析)
【题文】X、Y、Z三种元素的原子,其最外层电子排布为ns
1,3s
23p
1和2s
22p
4,由这三种元素组成的化合物的化学式可能是
| A.X2YZ3 | B.X2YZ2 | C.XYZ2 | D.XYZ3 |
题号:3207862
题型:选择题
难易度:较难
日期:2015-05-21
来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(带解析)
【题文】下列有关叙述中正确的是
| A.因为s轨道的形状是球形的,所以s电子做的是圆周运动 |
| B.3px、3py、3pz的差异之处在于三者中电子(基态)的能量不同 |
| C.原子轨道和电子云都是用来形象地描述电子运动状态的 |
| D.电子云图上的每一个点都代表一个电子 |
题号:3207863
题型:选择题
难易度:一般
日期:2015-05-21
来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(带解析)
题号:3207864
题型:选择题
难易度:较易
日期:2015-05-21
来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(带解析)
题号:4306865
题型:选择题
难易度:容易
日期:2015-05-23
来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(带解析)
【题文】在物质结构研究的历史上,首先提出原子内有电子学说的科学家是
题号:4306866
题型:选择题
难易度:较难
日期:2015-05-23
来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(带解析)
【题文】氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为
| A.两种分子的中心原子杂化轨道类型不同,NH3为sp2杂化,而CH4是sp3杂化 |
| B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道 |
| C.NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强 |
| D.氨气分子是极性分子而甲烷是非极性分子 |
题号:3207842
题型:填空题
难易度:较难
日期:2015-05-21
来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(带解析)
【题文】(9分)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D <E。其中A、B、C是同一周期的非金属元素,AC
2为非极性分子。D单质与水形成的溶液具有漂白性。E的原子序数为24,ED3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为
。
(2)已知A、D形成的化合物分子空间构型为正四面体,而光气(
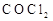
)分子空间构型为平面三角形,说明原因
。光气(
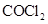
)分子中碳氧原子间的共价键的键型是
(填序号)。
A.1个
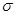
键 B.2
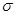
个键
C.2个
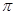
键 D.1个
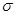
键,1个
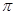
键
(3)写出等物质的量的D单质和SO
2气体同时通入水中反应的离子方程式
。
(4)ED3与B、C的氢化物形成的配合物的化学式为
。
题号:3207843
题型:填空题
难易度:较难
日期:2015-05-21
来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(带解析)
【题文】(12分)氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF
3和BN,如下图所示:
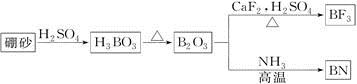
请回答下列问题:
(1)由B
2O
3制备BN的化学方程式是_____________________________________;
(2)B和N相比,电负性较大的是__________,BN中B元素的化合价为__________;
(3)在BF
3分子中,F—B—F的键角是________, B原子的杂化轨道类型为________;
(4)BF
3和过量NaF作用可生成NaBF
4,BF
4-的立体构型为________;
(5)六方氮化硼与石墨相似,层内B原子与N原子之间的化学键为_________,N原子L层的P电子比S电子多_________个。
(6)写出CaF
2的电子式:________。
题号:3207844
题型:填空题
难易度:困难
日期:2015-05-21
来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(带解析)
【题文】(12分)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
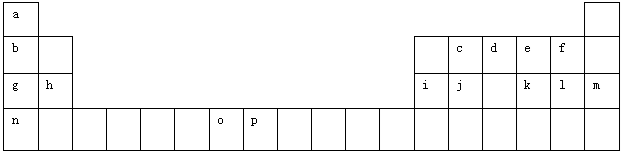
试回答下列问题:
(1)元素p的原子的电子占有
种能量不同的原子轨道。
(2)e、f、g、h四种元素形成的离子半径由大到小顺序为
(用离子符号表示)。
(3)单质d与单质a反应的产物的分子中中心原子的杂化形式为______________,该分子是______(填“极性”或“非极性”)分子。
(4)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:_____________。
(5)o、p两元素的部分电离能数据列于下表:
元素
| o
| p
|
电离能/kJ·mol-1
| I1
| 717
| 759
|
I2
| 1509
| 1561
|
I3
| 3248
| 2957
|
比较两元素的I2、I3可知,气态O
2+再失去一个电子比气态p
2+再失去一个电子难。对此,你的解释是_____________________________________________________;
(6)a、d、e可以形成一种盐,此盐的组成中a、d、e元素的原子个数比为4:2:3,此盐的化学式为
,含有的化学键为
。
题号:3207845
题型:填空题
难易度:较难
日期:2015-05-21
来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(带解析)
【题文】(12分)下列是A、B、C、D、E五种短周期元素的某些性质:
| A
| B
| C
| D
| E
| G
|
最低化合价
| -4
| -2
| -1
| -2
| -1
| —3
|
电负性
| 2.55
| 2.58
| 3.16
| 3.44
| 3.98
| 3.0
|
(1)A原子的核外电子排布的轨道表示式_______,C原子的价电子排布式________
(2)A、B、C、G对应的最高价氧化物的水化物酸性最强的是
(写化学式)。
(3)相同条件下,AD
2与BD
2分子在水中的溶解度较大的是_______
_(写化学式),
理由是________________________。
(4)A、B、D形成的氢化物沸点:________更高,热稳定性________更强(写化学式)。
(5)根据等电子原理(化学通式相同且价电子总数相等的分子或离子,结构相似),写出AD分子的结构式________。
(6)已知AG
-与G
2结构相似,推算HAG分子中σ键与π键数目之比为________。
题号:3207846
题型:填空题
难易度:较难
日期:2015-05-21
来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(带解析)
【题文】(15分)
(1)①比较0.1mol/L的下列各种溶液的pH大小:CH
3COONa_______NaClO;(填“>”、“<”或“=”)
②请按顺序排列出1mol/L (NH
4)
2SO
4溶液中各种离子浓度大小关系______________。
③25℃时,如果取0.2mol/LHA溶液与0.2mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=10。混合溶液中由水电离出的c(H
+)________0.1mol/LNaOH溶液中由水电离出的c(H
+);(填“>”、“<”、或“=”)
(2)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式________________
(3)在一定体积的密闭容器中,进行如下化学反应:CO
2(g)+H
2(g)
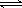
CO(g)+H
2O(g),其化学平衡常数K和温度t的关系如下表:
t℃
| 700
| 800
| 830
| 1000
| 1200
|
K
| 0.6
| 0.9
| 1.0
| 1.7
| 2.6
|
回答下列问题:
①该反应的化学平衡常数表达式为K=
。
②该反应为
反应(选填吸热、放热)。
③能判断该反应是否达到化学平衡状态的依据是
。
(A)容器中压强不变 (B)混合气体中 [CO]不变
(C)v
正(H
2)=v
逆(H
2O) (D)C
(CO
2)=C
(CO
)
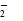
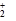
 N2(g)+3H2(g)的⊿H为
N2(g)+3H2(g)的⊿H为

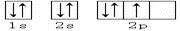
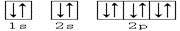

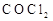 )分子空间构型为平面三角形,说明原因 。光气(
)分子空间构型为平面三角形,说明原因 。光气(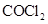 )分子中碳氧原子间的共价键的键型是 (填序号)。
)分子中碳氧原子间的共价键的键型是 (填序号)。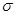 键 B.2
键 B.2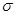 个键
个键 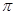 键 D.1个
键 D.1个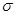 键,1个
键,1个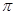 键
键

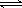 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表: