适用年级:{{getGradeNameByProperty('高三|月考试卷|福建|2015年')}} 试卷类型:{{getTestPaperTypeName('高三|月考试卷|福建|2015年')}} 使用省份:{{getAreaName('高三|月考试卷|福建|2015年')}}
试卷年份:{{getYear('高三|月考试卷|福建|2015年')}}上传日期:2015-07-01题数:11
提示:单击题文可显示答案与解析。
题号:3204410
题型:选择题
难易度:困难
日期:2015-07-01
来源:【百强校】2015届福建省福州一中高三5月质量检测试卷理综化学试卷(带解析)
【题文】文献报道某课题组利用CO
2催化氢化制甲烷的研究过程如下:

反应结束后,气体中检测到CH
4和H
2,滤液中检测到HCOOH,固体中检测到镍粉和Fe
3O
4。
CH
4、HCOOH、H
2的产量和镍粉用量的关系如右图所示(仅改变镍粉用量,其他条件不变):

研究人员根据实验结果得出结论:HCOOH是CO
2转化为CH
4的中间体,即:

由图可知,镍粉是反应Ⅰ、Ⅱ的催化剂,当镍粉用量从1mmol增加到10mmol,反应速率的变化情况是
| A.反应Ⅰ的速率增加,反应Ⅱ的速率不变 |
| B.反应Ⅰ的速率不变,反应Ⅱ的速率增加 |
| C.反应Ⅰ、Ⅱ的速率均增加,且反应Ⅰ的速率增加得快 |
| D.反应Ⅰ、Ⅱ的速率均增加,且反应Ⅱ的速率增加得快 |
题号:3204411
题型:选择题
难易度:较难
日期:2015-07-01
来源:【百强校】2015届福建省福州一中高三5月质量检测试卷理综化学试卷(带解析)
【题文】电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。已知:3I
2+6OH
-=IO
3-+5I
-+3H
2O
下列说法不正确的是
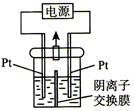
| A.右侧发生的电极方程式:2H2O+2e-=H2↑+2OH- |
| B.电解结束时,右侧溶液中含有IO3- |
C.电解槽内发生反应的总化学方程式KI+3H2O KIO3+3H2↑ KIO3+3H2↑ |
| D.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变 |
题号:3204412
题型:选择题
难易度:较难
日期:2015-07-01
来源:【百强校】2015届福建省福州一中高三5月质量检测试卷理综化学试卷(带解析)
【题文】下列实验方案中,不能达到实验目的的是
选项
| 实验目的
| 实验方案
|
A
| 检验淀粉是否水解生成葡萄糖
| 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后水解液用NaOH溶液中和,然后再加入新制Cu(OH)2浊液,加热,观察是否有红色沉淀生成
|
B
| 检验Fe(NO3)2晶体是否已氧化变质
| 将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,观察溶液是否变红
|
C
| 验证Br2的氧化性强于I2
| 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色
|
D
| 验证Fe(OH)3的溶解度小于Mg(OH)2
| 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色
|
题号:3204413
题型:选择题
难易度:较难
日期:2015-07-01
来源:【百强校】2015届福建省福州一中高三5月质量检测试卷理综化学试卷(带解析)
【题文】下列有关电解质溶液中粒子浓度关系正确的是
| A.pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③ |
| B.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) |
| C.CO2的水溶液:c(H+)>c(HCO3-)=2c(CO32-) |
| D.含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
题号:3204414
题型:选择题
难易度:较易
日期:2015-07-01
来源:【百强校】2015届福建省福州一中高三5月质量检测试卷理综化学试卷(带解析)
【题文】下列关于乙酸的说法不正确的是
| A.食醋中含有3%~5%的乙酸 |
| B.黄酒变酸是因为部分乙醇氧化为乙酸 |
| C.与甲酸甲酯互为同分异构体 |
| D.通过乙酸乙酯的碱性水解直接获取 |
题号:3204415
题型:选择题
难易度:较易
日期:2015-07-01
来源:【百强校】2015届福建省福州一中高三5月质量检测试卷理综化学试卷(带解析)
【题文】将足量的CO
2通入下列溶液中,最终溶液浑浊的是
①饱和苏打溶液 ②水玻璃 ③氯化钡 ④次氯酸钙
题号:3204407
题型:实验题
难易度:困难
日期:2015-07-01
来源:【百强校】2015届福建省福州一中高三5月质量检测试卷理综化学试卷(带解析)
【题文】(16分)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献.他以NaCl、NH
3、CO
2等为原料先制得NaHCO
3,进而生产出纯碱.有关反应的化学方程式为:
NH
3+CO
2+H
2O=NH
4HCO
3;
NH
4HCO
3+NaCl=NaHCO
3↓+NH
4Cl;
2NaHCO
3
Na
2CO
3+CO
2↑+H
2O
回答下列问题:
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是
(填字母标号)。
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
(Ⅰ)一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。

试回答下列有关问题:
①乙装置中的试剂是
。
②丁装置的作用是
。
(Ⅱ)另一位同学用图中戊装置(其它装置未画出)进行实验。
①实验时,须先从a管通入
气体(填气体分子式),再从b管通入
气体(填气体分子式)。
②有同学建议在戊装置的b管下端连接己装置,理由是
。
(3)“纯碱中常常会混有少量氯化钠。”某研究性学习小组以一包纯碱(只考虑含氯化钠)为研究对象,探究纯碱样品中碳酸钠的含量:
称取1.840 g小苏打样品(含少量NaCl),配置成250 mL溶液,取出25.00 mL用0.1000mol·L
-1盐酸滴定,消耗盐酸21.50 mL。
①实验中所需要的定量仪器除滴定管外,还有
。
②样品中NaHCO
3质量分数为
。
(4)将一定质量小苏打样品(只考虑含少量NaCl)溶于足量盐酸,蒸干后称量固体质量,也可测定小苏打的含量。若蒸发过程中有少量液体溅出,则测定结果
。(选填“偏高”、“偏低”或“不受影响”)
题号:3204408
题型:实验题
难易度:困难
日期:2015-07-01
来源:【百强校】2015届福建省福州一中高三5月质量检测试卷理综化学试卷(带解析)
【题文】(14分)高纯氧化铝可用于制高压钠灯的陶瓷管。实验室制取高纯氧化铝的流程如下:

(1)“除杂”操作是加入适量过氧化氢,用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中的少量Fe
2+。检验Fe
2+已除尽的实验操作是
。
(2)通常条件下,K
SP[Fe(OH)
3]=4.0×10
-38,除杂后溶液中c(Fe
3+)=
。
(3)配制硫酸铝溶液时,需用硫酸酸化,酸化的是目的是
。
(4)“结晶”操作中,母液经蒸发浓缩至溶液表面刚出现薄层的结晶为止,冷却结晶,得到铵明矾(含结晶水)。母液不能蒸干的原因是
。
(5)“分离”操作名称是
(填字母代号)
a.蒸馏 b.分液 c.过滤
(6)测定铵明矾组成的方法是:
a.称取0.906g铵明矾样品,高温灼烧,得Al
2O
3残留固体0.102g;
b.称取0.906g铵明矾样品,用适量蒸馏水溶解,再加入稍过量的BaCl
2溶液,经静置、过滤、洗净,得BaSO
40.932g;
c.称取0.906g样品,加入足量的NaOH溶液,加热,产生气体依次通过碱石灰和浓硫酸,浓硫酸增重0.0340g。
则铵明矾的化学式为
。
(7)有同学认为,第(6)问测定铵明矾组成的方法a、b、c三个试验中,有一个实验不必实施也能推导出铵明矾的化学式,您认为合理吗?若合理,请在下列空格写出不必实施的实验代号(即填上a、b、c其中的一个);若不合理,则在下列空格填上“不合理”,你的结论是
。
题号:3204405
题型:填空题
难易度:较难
日期:2015-07-01
来源:【百强校】2015届福建省福州一中高三5月质量检测试卷理综化学试卷(带解析)
【题文】【化学选修——有机基础化学】(13分)某有机化合物A的结构简式如图所示,回答下列问题。

(1)A能发生消去反应的官能团名称为
。
(2)A在NaOH水溶液中加热得B和C,C是芳香族化合物。
①B的结构简式是
。
②C酸化后可得到D,D不能发生的反应是
(填选项标号)
a.取代反应 b.水解反应 c.加成反应 d.消去反应
(3)D可以发生如下转化,且E与F互为同分异构体。

①F的结构简式是
。
②由D生成E的化学方程式
。
(4)符合下列三个条件的D的同分异构体种类有
种(不包括D)。
①只含有邻二取代苯环结构;
②与D具有相同的官能团;
③不与FeCl
3溶液发生显色反应
题号:3204406
题型:填空题
难易度:困难
日期:2015-07-01
来源:【百强校】2015届福建省福州一中高三5月质量检测试卷理综化学试卷(带解析)
【题文】【化学—物质结构与性质】(13分)硼及其化合物在现代工业、生活和国防中有重要应用价值。
(1)硼原子的电子排布式是
。
(2)最简单的硼烷是B
2H
6(乙硼烷),结构见下图,其中B原子的杂化方式为
。
(3)BF
3和BCl
3都有强烈接受孤电子对的倾向,如三氟化硼气体与氨气相遇,立即生成白色固体,写出该白色固体结构式,并标注出其中的配位键
。
(4)近年来,人们肯定硼是人和动物氟中毒的重要解毒剂。硼在体内可与氟形成稳定的配合物
,并以和氟相同的途径参加体内代谢,但毒性比氟小,且易随尿排出,故认为硼对氟化物具有解毒作用。
(5)经结构研究证明,硼酸晶体中B(OH)
3单元结构如图(1)所示。各单元中的氧原子通过O—H…O氢键连结成层状结构如图(2)所示。层与层之间以微弱的分子间力相结合构成整个硼酸晶体。

①H
3BO
3是一元弱酸,写出它与水反应的化学方程式
,
②根据结构判断下列说法正确的是
。
a.硼酸晶体属于原子晶体
b.硼酸晶体有鳞片状的外层
c.硼酸晶体是分子晶体
d.硼酸晶体有滑腻感,可作润滑剂
e.在B(OH)
3单元中,B原子以sp
3杂化轨道和氧原子结合而成
f.H
3BO
3分子的稳定性与氢键有关
g.含1mol H
3BO
3的晶体中有3mol氢键
h.分子中硼原子最外层为8e
-稳定结构
③硼酸常温下为白色片状晶体,溶于水(273K时溶解度为6.35),在热水中溶解度明显增大(373K时为27.6)。请分析其中原因
。
题号:3204409
题型:填空题
难易度:困难
日期:2015-07-01
来源:【百强校】2015届福建省福州一中高三5月质量检测试卷理综化学试卷(带解析)
【题文】(15分)元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是
。
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强
d.单质的熔点降低
(2)氧化性最弱的简单阳离子的结构示意图是
。
(3)晶体硅(熔点1410 ℃)是良好的半导体材料。由粗硅制纯硅过程如下:

在上述由SiCl
4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式
。
(4)Na
2S溶液长期放置有硫析出,原因为
(用离子方程式表示)。
(5)已知:2SO
2(g)+O
2(g)

2SO
3(g) 平衡常数为K
12NO(g)+O
2(g)

2NO
2(g) 平衡常数为K
2则反应NO
2(g)+SO
2(g)

SO
3(g)+NO(g)的平衡常数为K
3=
(用K
1、K
2来表达)
一定条件下,将NO
2与SO
2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO
2和NO的体积比保持不变
d.每消耗1 mol SO
3的同时生成1 mol NO
2测得上述反应平衡时NO
2与SO
2体积比为1∶6,则平衡常数K=
。
(6)KClO
3可用于实验室制O
2,若不加催化剂,400 ℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式
。




 KIO3+3H2↑
KIO3+3H2↑ Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O





 2SO3(g) 平衡常数为K1
2SO3(g) 平衡常数为K1 2NO2(g) 平衡常数为K2
2NO2(g) 平衡常数为K2 SO3(g)+NO(g)的平衡常数为K3= (用K1、K2来表达)
SO3(g)+NO(g)的平衡常数为K3= (用K1、K2来表达)