适用年级:{{getGradeNameByProperty('高三|月考试卷|福建|2014年')}} 试卷类型:{{getTestPaperTypeName('高三|月考试卷|福建|2014年')}} 使用省份:{{getAreaName('高三|月考试卷|福建|2014年')}}
试卷年份:{{getYear('高三|月考试卷|福建|2014年')}}上传日期:2014-12-12题数:12
提示:单击题文可显示答案与解析。
题号:3226795
题型:选择题
难易度:一般
日期:2014-12-12
来源:2015届福建省福州市第八中学高三上学期第三次质检理综化学试卷(带解析)
【题文】将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s)

2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
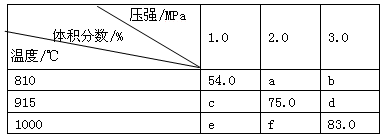
①b<f ②915℃、2.0MPa时E的转化率为60% ③该反应的△S>0 ④K(1000℃)>K(810℃),上述①~④中正确的有
题号:3226796
题型:选择题
难易度:较易
日期:2014-12-12
来源:2015届福建省福州市第八中学高三上学期第三次质检理综化学试卷(带解析)
【题文】
选项
| 目的
| 操作
|
A.
| 配制100 mL 1.0 mol/L CuSO4溶液
| 将25 g CuSO4·5H20溶于100 mL蒸馏水中
|
B.
| 除去KNO3中少量NaCl
| 将混合物制成热的饱和溶液,冷却结晶,过滤
|
C.
| 在溶液中将MnO4-完全转化为Mn2+
| 向酸性KMnO4溶液中滴加H2O2溶液至紫色消失
|
D.
| 确定NaCl溶液中是否混有Na2CO3
| 取少量溶液滴加CaCl2溶液,观察是否出现白色浑浊
|
题号:3226797
题型:选择题
难易度:一般
日期:2014-12-12
来源:2015届福建省福州市第八中学高三上学期第三次质检理综化学试卷(带解析)
【题文】解释下列事实的方程式不正确的是
| A.用碳酸钠溶液处理水垢中的硫酸钙:Ca2++CO32-=CaCO3↓ |
| B.硫酸型酸雨放置一段时间溶液的pH下降:2H2SO3+O2=2H2SO4 |
| C.向硅酸钠溶液中滴入稀盐酸得到胶体:Na2SiO3+2HCl=H2SiO3(胶体)+2NaCl |
| D.用石墨电极电解AlCl3溶液阴极附近生成沉淀:2Al3++6H2O+6e-=2Al(OH)3↓+3H2↑ |
题号:3226798
题型:选择题
难易度:容易
日期:2014-12-12
来源:2015届福建省福州市第八中学高三上学期第三次质检理综化学试卷(带解析)
【题文】生活处处有化学。下列说法正确的是
| A.制饭勺、饭盒、高压锅等的不锈钢是合金 |
| B.做衣服的棉和麻均与淀粉互为同分异构体 |
| C.煎炸食物的花生油和牛油都是可皂化的饱和酯类 |
| D.磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
题号:3226799
题型:选择题
难易度:容易
日期:2014-12-12
来源:2015届福建省福州市第八中学高三上学期第三次质检理综化学试卷(带解析)
【题文】下列有关物质应用的说法正确的是
| A.生石灰用作食品抗氧剂 | B.盐类都可作调味品 |
| C.铝罐可久盛食醋 | D.小苏打是面包发酵粉的主要成分之 |
题号:4310009
题型:选择题
难易度:一般
日期:2014-12-13
来源:2015届福建省福州市第八中学高三上学期第三次质检理综化学试卷(带解析)
【题文】2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。下列叙述错误的是
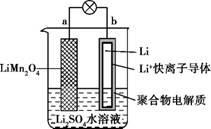
| A.a为电池的正极 |
B.电池充电反应为LiMn2O4 Li1-xMn2O4+xLi Li1-xMn2O4+xLi |
| C.放电时,a极锂的化合价发生变化 |
| D.放电时,溶液中Li+从b向a迁移 |
题号:4310010
题型:选择题
难易度:一般
日期:2014-12-13
来源:2015届福建省福州市第八中学高三上学期第三次质检理综化学试卷(带解析)
【题文】下列关于0.10 mol·L
-1 NaHCO
3溶液的说法正确的是
| A.溶质的电离方程式为NaHCO3=Na++ H++ CO32- |
| B.25 ℃时,加水稀释后,n(H+)与n(OH-)的乘积变大 |
| C.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
| D.温度升高,c(HCO3-)增大 |
题号:3226792
题型:实验题
难易度:较难
日期:2014-12-12
来源:2015届福建省福州市第八中学高三上学期第三次质检理综化学试卷(带解析)
【题文】(16分)Na
2S
2O
3是重要的化工原料,易溶于水。在中性或碱性环境中稳定。
I.制备Na
2S
2O
3•5H
2O反应原理:Na
2SO
3(aq)+S(s)

Na
2S
2O
3(aq)
实验步骤:
①称取15g Na
2SO
3加入圆底烧瓶中,再加入80ml蒸馏水。另取5g研细的硫粉,用3ml乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分加持装置略去),水浴加热,微沸60分钟。

③趁热过滤,将滤液水浴加热浓缩,冷却析出Na
2S
2O
3•5H
2O,经过滤,洗涤,干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是
。
(2)仪器a的名称是
。
(3)产品中除了有未反应的Na
2SO
3外,最可能存在的无机杂质是
,检验是否存在该杂质的方法是
。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子方程式表示产品发黄的原因
。
II.测定产品纯度准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 mol•L‾
1碘的标准溶液滴定。反应原理为:2S
2O
32‾+I
2=S
4O
62-+2I‾
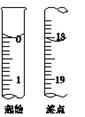
(5)滴定至终点时,溶液颜色的变化:
。
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为
mL。产品的纯度为(设Na
2S
2O
3•5H
2O相对分子质量为M)
。
题号:3226790
题型:填空题
难易度:较难
日期:2014-12-12
来源:2015届福建省福州市第八中学高三上学期第三次质检理综化学试卷(带解析)
【题文】(13分)【化学一有机化学基础】
I.莽草酸是有效应对H5N1型禽流感病毒的药物“达菲”的重要成分。
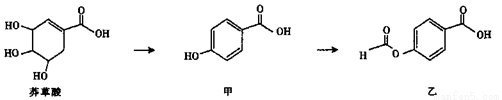
(1)莽草酸中可发生加成反应的官能团为______ (填名称)。
(2)等物质的量的莽草酸、甲、乙分别与NaOH溶液完全反应,消耗NaOH的物质的量之比为______。
(3)写出符合以下条件的莽草酸的同分异构体的结构简式____________。
(i)链状结构,含三种氢,有两个甲基。
(ii)能与NaOH溶液反应。
II.PET为聚合物,用于生产矿泉水塑料瓶。PET生产流程如下图:
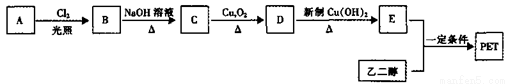
已知:A、B、C、D、E都是苯的对位二元取代物,A为烃,E与邻苯二甲酸互为同分异构体。
(4)B→C的反应类型为______。
(5)能鉴别C和D的试剂是______。
(6)E与乙二醇反应生成PET的化学方程式为____________。
题号:3226791
题型:填空题
难易度:一般
日期:2014-12-12
来源:2015届福建省福州市第八中学高三上学期第三次质检理综化学试卷(带解析)
【题文】(13分)【化学—物质结构与性质】
科技日报报道:辉钼(MoS
2)在纳米电子设备制造领域比硅或富勒烯(如C
60)更有优势。从不同角度观察MoS
2的晶体结构见图。已知:Mo位于第五周期VIB族。
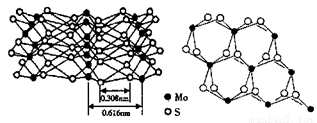
(1)晶体硅中硅原子的轨道杂化类型为______。
(2)电负性:C______S(填“>”或“<”)。
(3)晶体硅和C
60比较,熔点较高的是______。
(4)Mo元素基态原子的价电子排布式为____________。
(5)根据MoS
2的晶体结构回答:
①每个Mo原子周围距离最近的S原子数目为______。
②Mo-S之间的化学键为______(填序号)。
A极性键 B非极性键 C配位键 D金属键 E范德华力
③MoS
2纳米粒子具有优异的润滑性能,其原因是______。
题号:3226793
题型:填空题
难易度:一般
日期:2014-12-12
来源:2015届福建省福州市第八中学高三上学期第三次质检理综化学试卷(带解析)
【题文】(15分)电石是重要的工业原料,电石渣[主要成分Ca(OH)
2]的综合利用体现了绿色化学思想。
(1)用电石为原料可生产聚氯乙烯。聚氯乙烯的结构简式为____________。
(2)电石渣可用于除去垃圾焚烧炉烟道气中的SO
2生成CaSO
4,反应中的氧化剂是____________(填名称)。
(3)电石渣可用于生产纯碱。涉及的部分化学反应为:
(i)NaCl+NH
3+CO
2+H
2O=NaHCO
3↓+NH
4Cl
(ii)2NH
4Cl+Ca(OH)
2
CaCl
2+2NH
3↑+2H
2O
此生产过程中,可循环利用的物质有____________(填化学式)。
(4)用电石渣处理酸性含铬(Cr
2O
72—)电镀废水的流程如下:
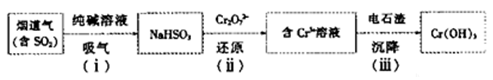
①步骤(i)发生反应的化学方程式为__________________
②步骤(ii)发生反应的离子方程式为__________________
③步骤(iii)调节溶液pH为8,则残留Cr
3+的浓度为___(K
sp[Cr(OH)
3]=6.3×10
—31)。
题号:3226794
题型:填空题
难易度:一般
日期:2014-12-12
来源:2015届福建省福州市第八中学高三上学期第三次质检理综化学试卷(带解析)
【题文】(14分)
(1)与OH
-电子数和质子数均相同的单核微粒的离子结构示意图为____________
(2)25
0C时,2.3 g酒精在血液中被氧气完全氧化放出66.8 kJ热量,该反应的热化学方程式为________________(3)汽车安全气囊中含MY
n和红棕色金属氧化 物。M、Y为短周期元素,其最外层电子数之和等于氧原子的最外层电子数,且可发生下图的转化。
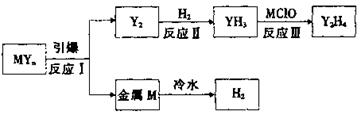
①写出元素符号:M______;Y_______.
②在2L密闭容器中,起始投入2 mol Y
2和3.5 mol H
2发生反应II,测得平衡时的数据如表。

若该反应ΔH <0,则T
1______T
2(填“ >”、“ <”或“=”);在温度T
2下,若经过10 min反应达到平衡,则平均速率v(YH
3)= ______,平衡常数为______ (保留两位有效数字)
③反应III的化学方程式为___________________。
 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:

 Li1-xMn2O4+xLi
Li1-xMn2O4+xLi Na2S2O3(aq)
Na2S2O3(aq)




 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O

