适用年级:{{getGradeNameByProperty('高三|月考试卷|福建|2014年')}} 试卷类型:{{getTestPaperTypeName('高三|月考试卷|福建|2014年')}} 使用省份:{{getAreaName('高三|月考试卷|福建|2014年')}}
试卷年份:{{getYear('高三|月考试卷|福建|2014年')}}上传日期:2014-11-12题数:12
提示:单击题文可显示答案与解析。
题号:3229798
题型:选择题
难易度:一般
日期:2014-11-12
来源:2015届福建省福州第八中学高三上学期第二次质量检查化学试卷(带解析)
【题文】25℃时,在含有Pb
2+、Sn
2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb
2+(aq)

Sn
2+(aq)+Pb(s),体系中c(Pb
2+)和c(Sn
2+)变化关系如下图所示。

下列判断正确的是
| A.往平衡体系中加入金属铅后,c(Pb2+)增大 |
| B.往平衡体系中加入少量Sn(NO3)2固体后, c(Pb2+)变小 |
| C.升高温度,平衡体系中c(Pb2+)增大,说明该反应⊿H>0 |
| D.25℃时,该反应的平衡常数K=2.2 |
题号:3229799
题型:选择题
难易度:一般
日期:2014-11-12
来源:2015届福建省福州第八中学高三上学期第二次质量检查化学试卷(带解析)
【题文】下列各选项所描述的两个量中,前者大于后者的是
| A.NH4Cl溶液中NH4+和Cl-数目 |
| B.纯水在100℃和25℃时的pH |
| C.完全中和相同pH且相同体积的氨水和NaOH溶液,所需的0.1mol·L-1盐酸体积 |
D.CH3COONa溶液加水稀释前后的 |
题号:3229800
题型:选择题
难易度:较易
日期:2014-11-12
来源:2015届福建省福州第八中学高三上学期第二次质量检查化学试卷(带解析)
【题文】在反应“X + 酸

化合物 + H
2O”中,X不可能是
题号:3229801
题型:选择题
难易度:一般
日期:2014-11-12
来源:2015届福建省福州第八中学高三上学期第二次质量检查化学试卷(带解析)
【题文】如图所示,X、Y、Z为短周期元素,且X、Z的核外电子数之和等于Y的核外电子数,下列说法不正确的是

| A.三种元素中,Z元素原子半径最小 |
| B.X、Y 两种元素的气态氢化物能相互反应 |
| C.Z位于元素周期表中第2周期、第ⅥA族 |
| D.Y元素的气态氢化物与X 的最高价氧化物对应的水化物能发生氧化还原反应 |
题号:3229802
题型:选择题
难易度:较易
日期:2014-11-12
来源:2015届福建省福州第八中学高三上学期第二次质量检查化学试卷(带解析)
【题文】下列说法正确的是:①植物油和裂化汽油都可以使溴水褪色;②糖类、油脂和蛋白质都能发生水解反应;③蛋白质溶液中加入浓的硫酸铵溶液会有沉淀析出;④防腐剂福尔马林可用作食品保鲜剂;⑤乙醇、乙酸、乙酸乙酯都能发生取代反应;⑥汽油、甘油和花生油都是混合物,无固定的沸点,只有花生油能与氢氧化钠溶液反应
题号:3229803
题型:选择题
难易度:较易
日期:2014-11-12
来源:2015届福建省福州第八中学高三上学期第二次质量检查化学试卷(带解析)
【题文】O、Si、Al是地壳中含量最多的三种元素,Na、Mg、Cl是海水中的重要元素。下列说法正确的是
| A.普通玻璃、水泥成分中都含有O、Si、Al三种元素 |
| B.从海水中制备Na、Mg、Al三种元素单质的反应都是氧化还原反应 |
| C.电解熔融状态的SiO2、Al2O3可以制得Si、Al,且都有氧气生成 |
| D.加热蒸干NaCl、MgCl2溶液时可以得到晶体NaCl、MgCl2 |
题号:4310657
题型:选择题
难易度:较难
日期:2014-11-13
来源:2015届福建省福州第八中学高三上学期第二次质量检查化学试卷(带解析)
【题文】最近有研究人员发现了一种处理高浓度乙醛废水的新方法—隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸。实验室以一定浓度的乙醛—Na
2SO
4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如右图所示。下列说法不正确的是

| A.若以CH4—空气燃料电池为直流电源,燃料电池的a极应通入空气 |
| B.阳极反应CH3CHO -2e- + H2O = CH3COOH +2H+ |
| C.电解过程中,阴极区Na2SO4的物质的量增大 |
| D.电解过程中,两极除分别生成乙酸和乙醇外,均产生了无色气体,则阳极产生的是O2 |
题号:3229795
题型:实验题
难易度:一般
日期:2014-11-12
来源:2015届福建省福州第八中学高三上学期第二次质量检查化学试卷(带解析)
【题文】(15分)I
2O
5是白色固体,遇水生成碘酸(HIO
3)。I
2O
5可用于检验并定量测定空气中的CO,在常温下发生的反应为 5CO+I
2O
5=5CO
2+I
2 (空气中其余气体不与I
2O
5反应)。
实验一:制取I
2O
5将碘酸加热至90~110 ºC使其部分脱水,再升温至220~240 ℃并恒温4 h,使反应完全。接着慢慢冷却至室温,密封保存,即得五氧化二碘。
(1)写出碘酸制I
2O
5的化学方程式:
。
(2)在制得的I
2O
5固体中含有少量I
2杂质,提纯的方法是
(填标号);
A.过滤 B.蒸发结晶 C.蒸馏 D.升华
用提纯方法用到的玻璃仪器为
(填标号)。
A.圆底烧瓶 B.烧杯 C.普通漏斗 D.酒精灯 E.玻璃棒
实验二:检验空气中CO
利用下图装置检验空气中是否存在CO。

(3)能说明空气中含有CO的现象是
。
(4)倘若要从广口瓶中出现浑浊来判断空气中含有CO,请写出改进的实验方案:
。
实验三:测定空气中CO的含量
(5)将I
2O
5与CO反应生成的碘单质用硫代硫酸钠滴定(反应为I
2+2Na
2S
2O
3=Na
2S
4O
6+2NaI),即可根据消耗硫代硫酸钠的量来计算空气中CO的含量。若某次实验时测得参与反应的空气体积为a mL(标准状况下),滴定过程中,共消耗v mL c mol·L
-1 Na
2S
2O
3溶液。则该空气样品中CO的体积分数是
。
(6)该实验测定出来的结果不可信,最大可能的原因是:
。
题号:3229794
题型:填空题
难易度:较难
日期:2014-11-12
来源:2015届福建省福州第八中学高三上学期第二次质量检查化学试卷(带解析)
【题文】[化学——有机化学基础](13分)
某课题组以甲苯为主要原料,采用以下路线合成化妆品防霉剂:对—羟基苯甲酸乙酯。


请回答:
(1)产品的摩尔质量为_____________________。
(2)在①~⑥的反应中属于取代反应的有_______________________。
(3)

在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式)
。
(4)

的同分异构体很多,其中符合下列条件有______种。
①遇到FeCl
3溶液出现显色现象;②能发生水解反应;③能发生银境反应;④无-CH
3结构。上述同分异构体中核磁共振氢谱显示其有5种峰的结构简式为
。
(5)高分子化合物

是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选)。注:合成路线的书写格式参照如下示例流程图:

题号:3229796
题型:填空题
难易度:较难
日期:2014-11-12
来源:2015届福建省福州第八中学高三上学期第二次质量检查化学试卷(带解析)
【题文】(14分)亚铁氰化钾(K
4Fe(CN)
6 ,黄血盐)在实验室、电镀、食品添加剂及医学上可用于冶疗铊(Tl)中毒、烧制青花瓷时可用于绘画等有广泛用途。已知HCN是一种极弱的酸。现有一种用含NaCN废水合成黄血盐的主要工艺流程如下:

(1)实验室用NaCN固体配制NaCN溶液时,为避免其水解,应先将其溶于
溶液,再用蒸馏水稀释,NaCN水解的离子方程式为_________。
(2)实验室K
4Fe(CN)
6可用于检验Fe
3+,生成的难溶盐KFe[Fe(CN)
6],生成的盐又可用于治疗Tl
2SO
4中毒,试写出上述检验Fe
3+反应的离子方程式为
。
(3)流程图中加入碳酸钠溶液主要目的是
。
(4)相同温度下溶解度:Na
4[Fe(CN)
6]
K
4[Fe(CN)
6](选填:“>”、“=”、“<”)。
(5)长期火炒添加有亚铁氰化钾的食盐,这时会发生分解反应,试配平下列方程式:3K
4Fe(CN)
6=□KCN+□Fe
3C+□C+□(CN)
2↑+□N
2↑
(6)电镀银时,电镀液不能直接用硝酸银溶液,可将其转变为K
4[Ag
2 (CN)
6],写出AgCl与黄血盐制取电镀液的离子方程式
。
题号:3229797
题型:填空题
难易度:较难
日期:2014-11-12
来源:2015届福建省福州第八中学高三上学期第二次质量检查化学试卷(带解析)
【题文】(16分)中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO
2、NOx等进行研究具有重要意义。请回答下列问题:
(1) 将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子
| K+
| Na+
| NH
| SO
| NO
| Cl-
|
浓度/mol•L-1
| 4×10-6
| 6×10-6
| 2×10-5
| 4×10-5
| 3×10-5
| 2×10-5
|
根据表中数据计算PM2.5待测试样的pH =
。
(2)NO
x是汽车尾气的主要污染物之一。汽车发动机工作时会引发N
2和O
2反应,其能量变化示意图如下:

①N
2(g)+O
2(g)

2NO(g) △H=
。
②当尾气中空气不足时,NO
x在催化转化器中被还原成N
2排出。写出NO被CO还原的化学方程式
。
(3) 碘循环工艺不仅能吸收SO
2降低环境污染,同时又能制得氢气,具体流程如下:

①用离子方程式表示反应器中发生的反应
。
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H
2的目的是_____________________。
③用吸收H
2后的稀土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池。电池充放电时的总反应为:Ni(OH)
2+M
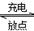
NiO(OH)+MH,电池放电时,负极电极反应式为
; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O
2,O
2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极电极反应式为
。
题号:4310658
题型:填空题
难易度:较难
日期:2014-11-16
来源:2015届福建省福州第八中学高三上学期第二次质量检查化学试卷(带解析)
【题文】[化学——物质结构与性质](13分)
物质结构理论有助于人们研究化学反应规律。请回答下列问题:
(1)在第三周期中,第一电离能大于硫的元素有
种;
(2)铜及其化合物在科学研究和工农业生产中有许多用途。
①铜原子价电子排布式为
②氯、钾、铜(+1价)三元素可形成一种化合物,该化合物阴离子为无限长链结构(如图甲),a位置上Cl原子的杂化轨道类型为
。该化合物阴离子的化学式为
;

③向CuSO
4溶液中加入过量氨水,可生成[Cu(NH
3)
4]SO
4,下列说法正确的是
。
| A.氨气极易溶液水,是因为NH3分子和H2O分子之间形成3种不同的氢键 |
| B.NH3分子的键角小于H2O分子的键角 |
| C.[Cu(NH3)4]SO4所含的化学键有离子键、极性共价键和配位键 |
| D.[Cu(NH3)4]SO4组成元素中电负性最大的是氮元素 |
④葡萄糖与新制氢氧化铜的碱性溶液反应生成砖红色沉淀A,其晶胞如右图乙所示。A的化学式为
,晶胞中的白点代表的原子是
(填元素名称)。
 Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。

 化合物 + H2O”中,X不可能是
化合物 + H2O”中,X不可能是




 在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式) 。
在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式) 。 的同分异构体很多,其中符合下列条件有______种。
的同分异构体很多,其中符合下列条件有______种。 是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选)。注:合成路线的书写格式参照如下示例流程图:
是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选)。注:合成路线的书写格式参照如下示例流程图:





 2NO(g) △H= 。
2NO(g) △H= 。
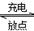 NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极电极反应式为 。
NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极电极反应式为 。