适用年级:{{getGradeNameByProperty('高三|月考试卷|福建|2016年')}} 试卷类型:{{getTestPaperTypeName('高三|月考试卷|福建|2016年')}} 使用省份:{{getAreaName('高三|月考试卷|福建|2016年')}}
试卷年份:{{getYear('高三|月考试卷|福建|2016年')}}上传日期:2016-04-22题数:12
提示:单击题文可显示答案与解析。
题号:1332363
题型:选择题
难易度:较易
日期:2016-09-13
来源:2016届福建省高中毕业班4月质量检查考试理综化学试卷(带解析)
【题文】中国丝绸有五千年的历史和文化。古代染坊常用某种“碱剂”来精炼丝绸,该“碱剂”的主要成分是一种盐,能促进蚕丝表层的丝胶蛋白杂质水解而除去,使丝绸颜色洁白、质感柔软、色泽光亮。这种“碱剂”可能是
题号:3143583
题型:选择题
难易度:一般
日期:2016-04-22
来源:2016届福建省高中毕业班4月质量检查考试理综化学试卷(带解析)
【题文】加热HCOONa固体,发生的反应有:
2HCOONa
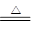
Na
2C
2O
4+H
2↑①
2HCOONa
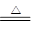
Na
2CO
3+H
2↑+CO
2↑②
Na
2C
2O
4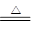
Na
2CO
3+CO↑③
HCOONa加热分解时,固体失重率与温度的关系如下图所示。下列说法正确的是
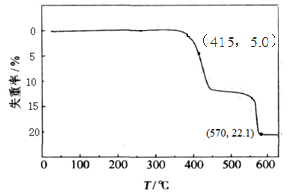
| A.T<415℃时,只有反应①发生 |
| B.反应①、②不可能同时发生 |
| C.570℃<T<600℃时,残留固体的主要成分是Na2CO3 |
| D.残留固体中m(Na2C2O4) = m( Na2CO3)时,反应①、②的反应速率相等 |
题号:3143584
题型:选择题
难易度:一般
日期:2016-04-22
来源:2016届福建省高中毕业班4月质量检查考试理综化学试卷(带解析)
【题文】用下图所示装置进行实验,能得出相应实验结论的是
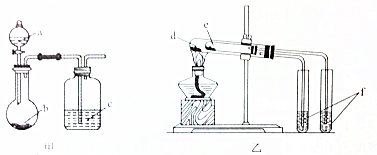
选项
| 实验试剂
| 实验结论
|
A
| a.稀硫酸
| b.碳酸氢钠
| c.硅酸钠溶液
| 酸性:硫酸>碳酸>硅酸
|
B
| a.稀盐酸
| b.二氧化锰
| c.溴化钠溶液
| 氧化性:MnO2>Cl2>Br2
|
C
| d.小苏打
| e.苏打
| f.石灰水
| 热稳定性:苏打>小苏打
|
D
| d.氯化钠
| e.氯化铵
| f.硝酸银溶液
| 沸点:氯化钠>氯化铵
|
题号:3143585
题型:选择题
难易度:一般
日期:2016-04-22
来源:2016届福建省高中毕业班4月质量检查考试理综化学试卷(带解析)
【题文】室温下,0.1 mol·L
−1 NaHCO
3溶液的pH=8.31,有关该溶液的判断正确的是
| A.c(Na+)>c(OH−)>c(HCO3−)>c(CO32−)>c(H+) |
| B.Ka1(H2CO3)·Ka2(H2CO3)<Kw |
| C.c(H+)+c(Na+)=c(OH−)+c(HCO3−)+c(CO32−) |
| D.加入适量NaOH溶液后:c(Na+)=c(H2CO3)+c(HCO3−)+c(CO32−) |
题号:3143586
题型:选择题
难易度:一般
日期:2016-04-22
来源:2016届福建省高中毕业班4月质量检查考试理综化学试卷(带解析)
【题文】一定条件下,实验室利用右图所示装置,通过测电压求算
Ksp(AgCl)。工作一段时间后,两电极质量均增大。下列说法错误的是
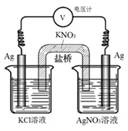
| A.该装置工作时化学能转化为电能 |
| B.左池中的银电极作正极 |
C.总反应为Ag+(aq) + Cl−(aq) AgCl(s) AgCl(s) |
| D.盐桥中的K+向右池方向移动 |
题号:3143587
题型:选择题
难易度:一般
日期:2016-04-22
来源:2016届福建省高中毕业班4月质量检查考试理综化学试卷(带解析)
【题文】W是由短周期元素X、Y、Z组成的盐。X、Y、Z原子的最外层电子数依次增大,Z原子最外层电子数是内层电子数的3倍;X、Y原子最外层电子数之和等于Z原子的最外层电子数;Y、Z同周期且相邻,但与X不同周期。下列说法一定正确的是
| A.三种元素的最高正化合价中,Z的最大 |
| B.W溶液显碱性或中性 |
| C.原子半径:X>Y>Z |
| D.Y的最高价氧化物对应的水化物是强酸 |
题号:3143588
题型:选择题
难易度:一般
日期:2016-04-22
来源:2016届福建省高中毕业班4月质量检查考试理综化学试卷(带解析)
【题文】茅台酒中存在少量具有凤梨香味的物质X,其结构如下图所示。下列说法正确的是
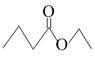
| A.X难溶于乙醇 |
| B.酒中的少量丁酸能抑制X的水解 |
| C.分子式为C4H8O2且官能团与X相同的物质有5种 |
| D.X完全燃烧后生成CO2和H2O的物质的量比为1∶2 |
题号:3143582
题型:实验题
难易度:困难
日期:2016-04-22
来源:2016届福建省高中毕业班4月质量检查考试理综化学试卷(带解析)
【题文】CuCl晶体呈白色,熔点为430℃,沸点为1490℃,见光分解,露置于潮湿空气中易被氧化,难溶于水、稀盐酸、乙醇,易溶于浓盐酸生成H
3CuCl
4,反应的化学方程式为CuCl(s)+3HCl(aq)

H
3CuCl
4(aq)。
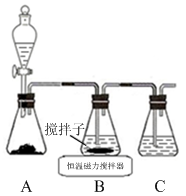
(1)实验室用下图所示装置制取CuCl,反应原理为:
2Cu
2++SO
2+8Cl
-+2H
2O===2CuCl
43-+SO+4H
+CuCl
43-(aq)

CuCl(s)+3Cl
-(aq)
①装置C的作用是
。
②装置B中反应结束后,取出混合物进行如下图所示操作,得到CuCl晶体。

操作ⅱ的主要目的是
操作ⅳ中宜选用的试剂是
。
③实验室保存新制CuCl晶体的方法是
。
④欲提纯某混有铜粉的CuCl晶体,请简述实验方案:
。
(2)某同学利用如下图所示装置,测定高炉煤气中CO、CO
2、N
2和O
2的百分组成。
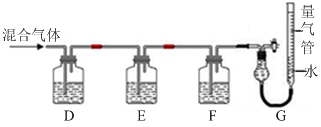
已知:
i.CuCl的盐酸溶液能吸收CO形成Cu(CO)Cl·H
2O。
ii.保险粉(Na
2S
2O
4)和KOH的混合溶液能吸收氧气。
①D、F洗气瓶中宜盛放的试剂分别是
、
。②写出保险粉和KOH的混合溶液吸收O
2的离子方程式:
。
题号:3143579
题型:填空题
难易度:较难
日期:2016-04-22
来源:2016届福建省高中毕业班4月质量检查考试理综化学试卷(带解析)
【题文】[化学——选修3:物质结构与性质]氢化铝钠(NaAlH
4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH
4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢。NaAlH
4可由AlCl
3和NaH在适当条件下合成。NaAlH
4的晶胞结构如右下图所示。
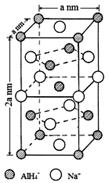
(1)基态Ti原子的价电子轨道表示式为
。
(2)NaH的熔点为800℃,不溶于有机溶剂。NaH属于
晶体,其电子式为
。
(3)AlCl
3在178℃时升华,其蒸气的相对分子质量约为267,蒸气分子的结构式为
(标明配位键)。
(4)AlH
4-中,Al的轨道杂化方式为
;例举与AlH
4-空间构型相同的两种离子
(填化学式)。
(5)NaAlH
4晶体中,与Na
+紧邻且等距的AlH
4-有
个;NaAlH
4晶体的密度为
g·cm
-3(用含a的代数式表示)。若NaAlH
4晶胞底心处的Na
+被Li
+取代,得到的晶体为
(填化学式)。
(6)NaAlH
4的释氢机理为:每3个AlH
4-中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近邻的Na原子转移到被释放的Al原子留下的空位,形成新的结构。这种结构变化由表面层扩展到整个晶体,从而释放出氢气。该释氢过程可用化学方程式表示为
。
题号:3143580
题型:填空题
难易度:困难
日期:2016-04-22
来源:2016届福建省高中毕业班4月质量检查考试理综化学试卷(带解析)
【题文】乙二醛(OHC—CHO)是一种重要的精细化工产品。
Ⅰ. 工业生产乙二醛
(1)乙醛(CH
3CHO)液相硝酸氧化法
在Cu(NO
3)
2催化下,用稀硝酸氧化乙醛制取乙二醛,反应的化学方程式为
。该法具有原料易得、反应条件温和等优点,但也存在比较明显的缺点是
。
(2)乙二醇(HOCH
2CH
2OH)气相氧化法
①已知:OHC—CHO(g) +2H
2(g)

HOCH
2CH
2OH(g) △
H=−78kJ·mol
−1 K12H
2(g) + O
2(g)

2H
2O(g) △
H=−484kJ·mol
−1 K2乙二醇气相氧化反应HOCH
2CH
2OH(g) +O
2(g)

OHC—CHO(g) + 2H
2O(g)的△
H=
kJ·mol
−1。相同温度下,该反应的化学平衡常数
K=
(用含
K1、
K2的代数式表示)。
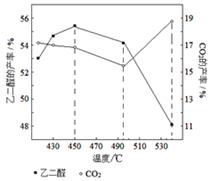
②当原料气中氧醇比为1.35时,乙二醛和副产物CO
2的产率与反应温度的关系如下图所示。反应温度在450~495℃之间和超过495℃时,乙二醛产率降低的主要原因分别是
、
。

Ⅱ. 乙二醛电解氧化制备乙醛酸(OHC—COOH)的生产装置如下图所示,通电后,阳极产生的Cl
2与乙二醛溶液反应生成乙醛酸。
(3)阴极反应式为
。
(4)阳极液中盐酸的作用,除了产生氯气外,还有
。
(5)保持电流强度为a A,电解t min,制得乙醛酸m g,列式表示该装置在本次电解中的电流效率
η=
。(设:法拉第常数为
f C•mol
−1;
η=

)
题号:3143581
题型:填空题
难易度:困难
日期:2016-04-22
来源:2016届福建省高中毕业班4月质量检查考试理综化学试卷(带解析)
【题文】以某菱锰矿(含MnCO
3、SiO
2、FeCO
3和少量Al
2O
3等)为原料通过以下方法可获得碳酸锰粗产品。
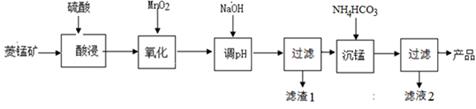
(已知:
Ksp(MnCO
3) = 2.2×10
−11,
Ksp[Mn(OH)
2] = 1.9×10
−13,
Ksp[Al(OH)
3] = 1.3×10
−33)
(1)滤渣1中,含铁元素的物质主要是
(填化学式,下同);加NaOH调节溶液的pH约为5,如果pH过大,可能导致滤渣1中
含量减少。
(2)滤液2中,+1价阳离子除了H
+外还有
(填离子符号)。
(3)取“沉锰”前溶液a
mL于锥形瓶中,加入少量AgNO
3溶液(作催化剂)和过量的1.5%(NH
4)
2S
2O
8溶液,加热,Mn
2+被氧化为MnO
4−,反应一段时间后再煮沸5min[除去过量的(NH
4)
2S
2O
8],冷却至室温。选用适宜的指示剂,用b mol·L
−1的(NH
4)
2Fe(SO
4)标准溶液滴定至终点,消耗(NH
4)
2Fe(SO
4)
2标准溶液V mL。
① Mn
2+与(NH
4)
2S
2O
8反应的还原产物为
(填化学式)。
② “沉锰”前溶液中
c(Mn
2+) =
mol·L
−1(列出表达式)。
(4)其他条件不变,“沉锰”过程中锰元素回收率与NH
4HCO
3初始浓度(
c0)、反应时间的关系如下图所示。
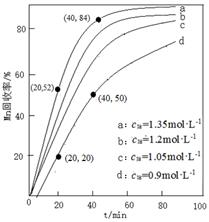
①NH
4HCO
3初始浓度越大,锰元素回收率越
(填“高”或“低”),简述原因
。
② 若溶液中
c(Mn
2+) =" 1.0" mol·L
−1,加入等体积1.8 mol·L
−1 NH
4HCO
3溶液进行反应,计算20~40 min内
v(Mn
2+) =
。
题号:3143578
题型:推断题
难易度:困难
日期:2016-04-22
来源:2016届福建省高中毕业班4月质量检查考试理综化学试卷(带解析)
【题文】[化学——选修5:有机化学基础]乙基香兰素是最重要的合成香料之一,常作为婴幼儿奶粉的添加剂。制备乙基香兰素的一种合成路线(部分反应条件略去)如下图所示:
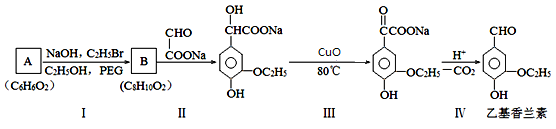
已知:① R—ONa + R’—Br —→ R—O—R’ + NaBr
② Ⅲ中生成的Cu
2O经氧化后可以循环利用
回答下列问题:
(1)A的核磁共振氢谱有3组峰。A的结构简式为
。
(2)Ⅰ中可能生成的一种烃是
(填名称);催化剂PEG可看作乙二醇脱水缩聚的产物,PEG的结构简式为
。若PEG的平均相对分子质量为17618,则其平均聚合度约为
。
(3)Ⅱ中,发生的反应属于
(填反应类型)。
(4)Ⅲ中,反应的化学方程式为
。
(5)Ⅳ中,有机物脱去的官能团是
(填名称)。
(6)D是乙基香兰素的同分异构体,其分子结构中不含乙基。由A制备D的一种合成路线(中间产物及部分反应条件略去)如下图所示:
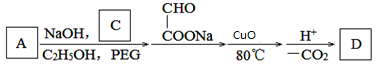
C和D的结构简式分别为
、
。
 Na2C2O4+H2↑①
Na2C2O4+H2↑①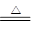 Na2CO3+H2↑+CO2↑②
Na2CO3+H2↑+CO2↑②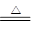 Na2CO3+CO↑③
Na2CO3+CO↑③


 AgCl(s)
AgCl(s)
 H3CuCl4(aq)。
H3CuCl4(aq)。
 CuCl(s)+3Cl-(aq)
CuCl(s)+3Cl-(aq)


 HOCH2CH2OH(g) △H=−78kJ·mol−1 K1
HOCH2CH2OH(g) △H=−78kJ·mol−1 K1 2H2O(g) △H=−484kJ·mol−1 K2
2H2O(g) △H=−484kJ·mol−1 K2 OHC—CHO(g) + 2H2O(g)的△H= kJ·mol−1。相同温度下,该反应的化学平衡常数K= (用含K1、K2的代数式表示)。
OHC—CHO(g) + 2H2O(g)的△H= kJ·mol−1。相同温度下,该反应的化学平衡常数K= (用含K1、K2的代数式表示)。

 )
)


