适用年级:{{getGradeNameByProperty('高二|月考试卷|福建|2014年')}} 试卷类型:{{getTestPaperTypeName('高二|月考试卷|福建|2014年')}} 使用省份:{{getAreaName('高二|月考试卷|福建|2014年')}}
试卷年份:{{getYear('高二|月考试卷|福建|2014年')}}上传日期:2014-04-17题数:21
提示:单击题文可显示答案与解析。
题号:3248504
题型:选择题
难易度:较易
日期:2014-04-17
来源:2013-2014学年福建省龙岩市高二第一学期教学质量检测化学试卷(带解析)
【题文】有人建议用AG表示溶液酸度,AG定义为 AG=lg[c(H+)/c(OH-)]。回答下列问题:
(1)25℃时,溶液的AG与其pH之间的关系为AG= 。
(2)25℃时,一元弱碱MOH溶液的AG=-8。取20mL该MOH溶液,当与16.2mL 0.05 mol/L硫酸混合时,两者恰好完全中和。求此条件下该一元弱碱的电离平衡常数。
题号:3248509
题型:选择题
难易度:一般
日期:2014-04-17
来源:2013-2014学年福建省龙岩市高二第一学期教学质量检测化学试卷(带解析)
【题文】少量二氧化碳通入NaCN溶液中,发生如下反应:CO
2 + H
2O + CN
- =HCO
3- + HCN。以下说法正确的是(温度均为25℃)
| A.电离常数:K(HCN) <Ka2 (H2CO3) |
| B.浓度均为0.1mol·L-1的NaCN和NaHCO3溶液的pH:NaCN <NaHCO3 |
| C.浓度均为0.1mol·L-1的NaCN和Na2CO3溶液中,阴离子总浓度相等 |
| D.pH均为10的 Na2CO3溶液、NaCN溶液中,水电离产生的c(OH-)相等 |
题号:3248510
题型:选择题
难易度:一般
日期:2014-04-17
来源:2013-2014学年福建省龙岩市高二第一学期教学质量检测化学试卷(带解析)
【题文】某化学兴趣小组为探究电化学原理,设计了如图装置(铁、铜为电极,烧杯中盛装硫酸铜溶液)。下列叙述不正确的是
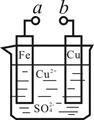
| A.a和b不连接时,铁片上会有金属铜析出 |
| B.a和b用导线连接时,铁片上发生的反应为:Fe-3e- = Fe3+ |
| C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
| D.a和b分别连接直流电源正、负极,Cu2+向铜电极移动 |
题号:3248511
题型:选择题
难易度:一般
日期:2014-04-17
来源:2013-2014学年福建省龙岩市高二第一学期教学质量检测化学试卷(带解析)
【题文】将氯化铝溶液蒸干并灼烧后得到纯净的固体A,将A在高温下熔融后用铂电极进行电解,下列有关电极产物的判断正确的是
| A.阴极产物是氢气 | B.阳极产物是氧气 |
| C.阴极产物是铝和氧气 | D.阳极产物只有氯气 |
题号:3248512
题型:选择题
难易度:一般
日期:2014-04-17
来源:2013-2014学年福建省龙岩市高二第一学期教学质量检测化学试卷(带解析)
【题文】Li-A1/FeS电池是一种正在开发的车载电池,该电池中正极电极反应式为:2Li
++FeS+2e
- =Li
2S+Fe。有关该电池的叙述正确的是( )
| A.该电池的总反应式为:2Li+FeS=Li2S+Fe |
| B.Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价 |
| C.负极的电极反应式为Al-3e-=Al3+ |
| D.充电时,阴极的电极反应式为:Li2S+Fe-2e- = 2Li++FeS |
题号:3248513
题型:选择题
难易度:一般
日期:2014-04-17
来源:2013-2014学年福建省龙岩市高二第一学期教学质量检测化学试卷(带解析)
【题文】已知:25℃时,Ka(HAc)=1.7×10-5 mol /L。现有如下溶液:
①0.1mol/LHAc与0.1mol/LNaOH溶液等体积混合液
②pH = 3的HAc与pH = 11的NaOH溶液等体积混合液
③0.1 mol /LH
2SO
4与0.2mol/LNaOH溶液等体积混合液
常温时,三者pH大小关系正确的是
| A.①>③>② | B.③>①>② | C.①>②>③ | D.②>③>① |
题号:3248514
题型:选择题
难易度:较易
日期:2014-04-17
来源:2013-2014学年福建省龙岩市高二第一学期教学质量检测化学试卷(带解析)
【题文】如图为某种甲醇燃料电池示意图,工作时电子流方向如图所示。下列判断正确的是
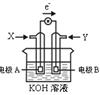
| A.X为氧气 |
| B.电极A反应式:CH3OH-6e-+H2O = CO2+6H+ |
| C.B电极附近溶液pH增大 |
| D.电极材料活泼性:A>B |
题号:3248515
题型:选择题
难易度:一般
日期:2014-04-17
来源:2013-2014学年福建省龙岩市高二第一学期教学质量检测化学试卷(带解析)
题号:3248516
题型:选择题
难易度:较易
日期:2014-04-17
来源:2013-2014学年福建省龙岩市高二第一学期教学质量检测化学试卷(带解析)
【题文】下列措施不能增大反应速率的是
| A.锌与稀硫酸反应时,加少量铜粉 |
| B.Fe与稀硫酸反应制取H2时,改用98%浓硫酸 |
| C.Al在氧气中燃烧生成A12O3,将铝片改成铝粉 |
| D.恒温时,增大H2(g)+Br2(g) ⇌2HBr(g)反应体系的压强 |
题号:3248517
题型:选择题
难易度:较易
日期:2014-04-17
来源:2013-2014学年福建省龙岩市高二第一学期教学质量检测化学试卷(带解析)
【题文】下列描述不符合生产、生活实际的是
| A.家用炒锅残留盐溶液时易发生吸氧腐蚀 |
| B.电解法精炼粗铜,用纯铜作阴极 |
| C.电解水制氢气时,用铜作阳极 |
| D.在镀件上电镀锌,用锌作阳极 |
题号:3248518
题型:选择题
难易度:一般
日期:2014-04-17
来源:2013-2014学年福建省龙岩市高二第一学期教学质量检测化学试卷(带解析)
【题文】已知:N
2(g)+3H
2(g) ⇌ 2 NH
3(g) △H =" -92.4" kJ/mol。一定条件下,现有容积相同且恒容的密闭容器甲与乙:① 向甲中通入1 mol N
2和3 mol H
2,达到平衡时放出热量Q
1 kJ;② 向乙中通入0.5 mol N
2 和1.5 mol H
2,达到平衡时放出热量Q
2 kJ。则下列关系式正确的是
| A.92.4>Ql>2Q2 | B.92.4=Q1<2Q2 |
| C.Q1=2Q2=92.4 | D.Q1=2Q2<92.4 |
题号:3248519
题型:选择题
难易度:一般
日期:2014-04-17
来源:2013-2014学年福建省龙岩市高二第一学期教学质量检测化学试卷(带解析)
【题文】在一密闭容器中,反应 aA(g)

bB(g)+cC(g)达平衡后,保持温度不变,将容器体积增加一倍,最终测得A的物质的量的浓度变为原来的50%,则
| A.平衡向正反应方向移动 | B.a>(b+c) |
| C.物质B的质量分数增大 | D.以上判断都错误 |
题号:3248520
题型:选择题
难易度:较易
日期:2014-04-17
来源:2013-2014学年福建省龙岩市高二第一学期教学质量检测化学试卷(带解析)
【题文】对于①需加热才发生的反应、②放热反应、③熵增加的反应,可能属于自发反应的是
题号:3248521
题型:选择题
难易度:较易
日期:2014-04-17
来源:2013-2014学年福建省龙岩市高二第一学期教学质量检测化学试卷(带解析)
【题文】下列溶液一定显酸性的是
| A.含H+的溶液 |
| B.c(OH-)<c(H+)的溶液 |
| C.pH<7的溶液 |
| D.能与金属Al反应放出H2的溶液 |
题号:4315010
题型:选择题
难易度:一般
日期:2014-04-17
来源:2013-2014学年福建省龙岩市高二第一学期教学质量检测化学试卷(带解析)
【题文】已知化学反应A
2(g) + B
2(g) = 2AB(g)的能量变化如图所示,下列叙述正确的是
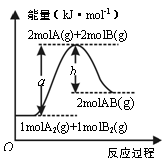
| A.每生成2分子AB吸收bkJ热量 |
| B.该反应热△H=(b -a)kJ·mol-1 |
| C.反应物的总能量低于生成物的总能量 |
| D.断裂1molA—A和1molB—B键,放出akJ能量 |
题号:4315011
题型:选择题
难易度:一般
日期:2014-04-17
来源:2013-2014学年福建省龙岩市高二第一学期教学质量检测化学试卷(带解析)
【题文】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH
4I(s)

NH
3(g) + HI(g) ②2HI(g)

H
2(g) + I
2(g)
达到平衡时,c(H
2)=0.5mol/L,c(NH
3)=4mol/L,则此温度下反应①的平衡常数为
题号:3248505
题型:填空题
难易度:一般
日期:2014-04-17
来源:2013-2014学年福建省龙岩市高二第一学期教学质量检测化学试卷(带解析)
【题文】现有常温下的0.1 mol/l纯碱溶液。
(1)该溶液呈碱性是因为存在水解平衡,相关离子方程式是:________________。为证明存在上述平衡,进行如下实验:在0.1 mol·l
-1纯碱溶液中滴加酚酞,溶液显红色,再往溶液中滴加
(填化学式)溶液,红色逐渐退为无色,说明上述观点成立。
(2)同学甲查阅资料得知0.1 mol/LNa
2CO
3中,发生水解的CO
32—不超过其总量的10%。请设计实验加以证明(写出实验方案及预期观察到的现象)。答
: 。
(3)同学乙就该溶液中粒子浓度关系写出五个关系式,其中不正确的是
。
| A.c(Na+)>2c(CO32—) |
| B.c(CO32—)>c(OH-)>c(HCO3—)>c(H2CO3) |
| C.c(OH-)=c(H+)+c(HCO3—)+2c(H2CO3) |
| D.c(CO32—)+c(HCO3—)="0.1" mol·L-1 |
E.c(H
+)+ c(Na
+)= c(OH
-)+c(HCO
3—)+c(CO
32—)
(4)室温下pH均为a的Na
2CO
3和NaOH溶液中,水电离产生的c(OH
—)之比=
。
题号:3248506
题型:填空题
难易度:一般
日期:2014-04-17
来源:2013-2014学年福建省龙岩市高二第一学期教学质量检测化学试卷(带解析)
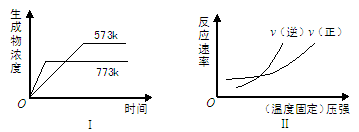
【题文】在一恒温、恒容密闭容器中充入1mol CO
2和3 mol H
2,一定条件下发生反应:
CO
2(g)+3H
2(g)
CH
3OH (g)+H
2O(g) △H=-49.0 kJ/mol
某种反应物和生成物的浓度随时间变化如图所示。回答下列问题:
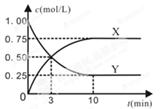
(1)Y的化学式是
。
(2)反应进行到3min时, v
正 v
逆(填“>”或“<”、“=”)。反应前3min,H
2的平均反应速率v(H
2)=
mol·L
-1·min
-1。
(3)不能判断该反应达到化学平衡状态的依据是
。
| A.容器内各气体的体积比保持不变 | B.混合气体密度不变 |
| C.3v逆(CH3OH) =v正(H2) | D.H2转化率为75% |
(4)上述反应达到平衡后,往容器中同时加入1molCO
2和1mol H
2O(g),此时平衡将
(填“向左”、“向右”或“不”)移动。
(5)上述温度下,反应CH
3OH (g) + H
2O(g)
CO
2(g) + 3H
2(g)的平衡常数K=
(计算结果保留2位小数)。
题号:3248507
题型:填空题
难易度:一般
日期:2014-04-17
来源:2013-2014学年福建省龙岩市高二第一学期教学质量检测化学试卷(带解析)
【题文】某兴趣小组利用如图所示装置进行实验。
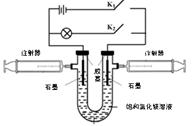
(1)断开K
2、闭合K
1,U形管内除电极上有气泡外,还可观察到的现象是
;阳极电极反应式为
。当电路中转移0.001mol电子时,右侧注射器最多可以收集到气体
mL(折算为标准状况)。
(2)断开K
2、闭合K
1一段时间,待注射器中充有一定量的气体后,断开K
1、闭合K
2,此时装置内化学能转化为电能。实现能量转化的化学方程式为
;
(3)假设实验装置不漏气,当(2)中注射器内气体全部参加反应后,U形管内的溶液理论上
(填“能”或“不能”)恢复原样。
题号:3248508
题型:填空题
难易度:一般
日期:2014-04-17
来源:2013-2014学年福建省龙岩市高二第一学期教学质量检测化学试卷(带解析)
【题文】工业上常常利用反应①来生产环氧乙烷,但是伴随副反应②。
①C
2H
4(g)+
O
2(g) →
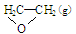
; △H
1 ②C
2H
4(g)+3O
2(g) → 2CO
2(g)+2H
2O(g); △H
2(1)写出环氧乙烷充分燃烧的热化学反应方程式。答:____________________________;
(2)工业生产中,可通过某一措施来加快反应①而对反应②影响较小,从而提高环氧乙烷的生产效率。工业生产采取的这种措施是_______________。
A.升高反应体系的温度B.增大体系中氧气的浓度
C.使用合适的催化剂D.降低反应体系的压强
(3)已知C=C、O=O、C—C键能分别为a kJ·mol
-1、b kJ·mol
-1、c kJ·mol
-1,则环氧乙烷中C—O键能为
kJ·mol
-1;
(4)反应②可以设计成燃料电池,若以酸做电解质溶液,负极反应式是
。
题号:4315012
题型:填空题
难易度:较难
日期:2014-04-17
来源:2013-2014学年福建省龙岩市高二第一学期教学质量检测化学试卷(带解析)
【题文】KMnO
4酸性溶液与草酸(H
2C
2O
4)溶液反应时,溶液紫色会逐渐褪去。某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响。该实验条件作如下限定:
①所用KMnO
4酸性溶液的浓度可选择:0.02 mol·L
-1、0.002 mol·L
-1;
②所用H
2C
2O
4溶液的浓度可选择:0.2 mol·L
-1、0.4 mol·L
-1;
③每次实验时KMnO
4酸性溶液的用量均为4 mL、H
2C
2O
4溶液的用量均为2mL。
(1)若要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成____ 组实验进行对比即可得出结论。
(2)在其它条件相同的情况下,某同学改变KMnO
4酸性溶液的浓度,测得实验数据(从混合振荡均匀开始计时)如下表所示:
KMnO4酸性溶液浓度
(mol·L-1)
| 溶液褪色所需时间(min)
|
|
第一次
| 第二次
| 第三次
|
0.02
| 14
| 13
| 11
|
0.002
| 6.7
| 6.6
| 6.7
|
| | | | |
①用0.002 mol/L KMnO
4酸性溶液进行实验时,KMnO
4的平均反应速率(忽略混合前后溶液体积变化)。
②依据表中数据,不能得出“溶液的褪色所需时间越短,反应速率越快”的结论。某同学设计以下方案,可以直接得出“褪色时间越短,反应的速率越快”结论。
KMnO4酸性溶液
| H2C2O4溶液
|
浓度/ mol/L
| 体积(ml)
| 浓度/ mol/L
| 体积(ml)
|
0.02
| 2
| b
| 4
|
a
| 2
| c
| 4
|
则表中a=
;b=
;c=
。
(3)草酸电离常数:Ka
1=5.9×10
-2,Ka
2=6.4×10
-5。与KMnO
4反应时,它将转化为CO
2和H
2O。
①草酸与酸性高锰酸钾溶液反应的离子方程式为
。
②室温下,0.1mol·L
-1 KHC
2O
4酸溶液中pH
7,理由是
。
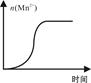
(4)测得某次实验(恒温)时溶液中Mn
2+物质的量与时间关系如图。请解释n(Mn
2+)在反应起始时变化不大、一段时间后快速增大的原因:
。


 2NH3(g) ΔH<0
2NH3(g) ΔH<0 2SO2(g)+O2(g) ΔH>0
2SO2(g)+O2(g) ΔH>0 C(s)+H2O(g) ΔH>0
C(s)+H2O(g) ΔH>0 4NO(g)+6H2O(g) ΔH<0
4NO(g)+6H2O(g) ΔH<0 bB(g)+cC(g)达平衡后,保持温度不变,将容器体积增加一倍,最终测得A的物质的量的浓度变为原来的50%,则
bB(g)+cC(g)达平衡后,保持温度不变,将容器体积增加一倍,最终测得A的物质的量的浓度变为原来的50%,则
 NH3(g) + HI(g) ②2HI(g)
NH3(g) + HI(g) ②2HI(g)  H2(g) + I2(g)
H2(g) + I2(g) CH3OH (g)+H2O(g) △H=-49.0 kJ/mol
CH3OH (g)+H2O(g) △H=-49.0 kJ/mol
 CO2(g) + 3H2(g)的平衡常数K= (计算结果保留2位小数)。
CO2(g) + 3H2(g)的平衡常数K= (计算结果保留2位小数)。
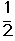 O2(g) →
O2(g) →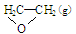 ; △H1 ②C2H4(g)+3O2(g) → 2CO2(g)+2H2O(g); △H2
; △H1 ②C2H4(g)+3O2(g) → 2CO2(g)+2H2O(g); △H2