| A.离子半径:Na+>N3->H+ |
| B.反应①和②都是氧化还原反应 |
| C.反应②每生成1 mol H2,转移的电子数为NA |
| D.Na3N和NaH与盐酸反应都只生成一种盐 |

| A.I、Ⅱ分别表示盐酸和醋酸的滴定曲线 |
| B.盐酸和醋酸的浓度均为0.100 0 mol·L-1 |
| C.pH=7时,两种酸所消耗NaOH溶液的体积相等 |
| D.V(NaOH)=20.00mL时,c(Cl一)=c(CH3COO一) |
| A.同浓度的Na2SO4和Na2CO3混合溶液中滴加BaCl2溶液,BaSO4先析出 |
| B.BaCO3的悬浊液中加入少量的新制氯水,c(Ba2+)增大 |
C.BaSO4和BaCO3共存的悬浊液中, = = |
| D.BaSO4悬浊液中加入Na2CO3浓溶液,BaSO4不可能转化为BaCO3 |
| ① | ② | ③ | ④ |
| 0.1 mol·L-1氨水 | pH=11氨水 | 0.1 mol·L-1盐酸 | pH=3盐酸 |

| A.用图1装置蒸干CuCl2饱和溶液制备CuCl2晶体 |
| B.用图2装置制取二氧化碳气体 |
| C.用图3装置蒸馏海水制取少量淡水 |
| D.用图4装置分离乙醇与乙酸乙酯的混合物 |

| A.(C6H10O5)n可表示淀粉或纤维素 |
B.反应②化学方程式为C6H12O6 2C2H5OH+2CO2↑ 2C2H5OH+2CO2↑ |
| C.反应③得到的乙酸乙酯中含有乙醇和乙酸,可用饱和氢氧化钠溶液除去 |
| D.反应③和④都属于取代反应 |
A.工业上用电解法制备烧碱:2Cl一+H2O 2OH一+H2↑+Cl2↑ 2OH一+H2↑+Cl2↑ |
| B.用食醋除去水垢中的CaCO3:CaCO3+2H+=Ca2++H2 O+ CO2↑ |
C.NH4HCO3溶液中加过量NaOH溶液并加热:NH4++OH- H2O+NH3↑ H2O+NH3↑ |
| D.铜溶于硫酸酸化的过氧化氢溶液:Cu+2H++H2O2=Cu2++2H2 O |
| A.镀锌铁的镀层破损后,镀层仍然对铁起保护作用 |
| B.SiO2不溶于强酸和强碱,可用于制光导纤维 |
| C.C12与SO2使品红溶液褪色的原理相同 |
| D.常温下浓硫酸与铝不反应,可用铝槽车运输 |
| A.1molC2H6中共价键数为8NA |
| B.3.2 g O2和O 3的混合气中氧原子数为0.2NA |
| C.1L 0.1mol·L-1Al2(SO4)3溶液中Al3+数为0.2NA |
| D.标准状况下,22.4 L甲醇的分子数为NA |
A.中子数为14的硅原子: |
B.CH4分子的比例模型: |
C.聚乙烯的结构简式: |
| D.次氯酸分子的结构式:H—O-Cl |
| | A | B | C | D |
| 污染 | 白色污染 | PM2.5 | 氮氧化物 | 水体富营养化 |
| 来源 | 废弃塑料 | 化石燃料燃烧 | 汽车尾气 | 石油化工废弃物 |
| A.聚丙烯能使酸性高锰酸钾溶液褪色 |
| B.分馏石油得到的各馏分都是纯净物 |
| C.蛋白质水解和油脂皂化都是高分子转化成小分子的过程 |
| D.C4H10有2种同分异构体 |
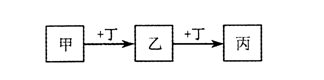
| A.若甲是AlCl3溶液,则丁可能是NaOH溶液 |
| B.若甲是Fe,则丁可能是Cl2 |
| C.若丁是CO2,则甲可能为Mg |
| D.若丁是O2,则乙、丙的相对分子质量可能相差16 |
| A.滴定实验时,锥形瓶用蒸馏水洗净后,直接盛待测液 |
| B.用100 mL量筒配制100 mL 0.100 0 mol·L-1 Na2CO3溶液 |
| C.用铂丝蘸取少量某溶液进行焰色反应,若火焰呈黄色,则原溶液含有钠盐 |
| D.某溶液加入盐酸酸化的BaCl2溶液,若有白色沉淀生成,则原溶液含有SO42- |
| A.c(H+)=1.0×10-12mol·L-1的溶液:K+、Mg2+、CH3COO一、Br— |
| B.甲基橙呈红色的溶液:NH4+、Ba2+、NO3一、Cl一 |
| C.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
| D.含1.0 mol·L-1 KNO3的溶液:Cl-、SO42-、H+、Fe2+ |
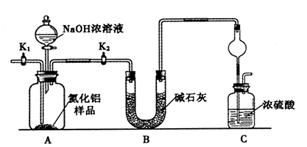



 Fe(OH)3+5OH-]
Fe(OH)3+5OH-]


 4Fe(OH)3+8OH-+3O2。实验测得K2FeO4溶液浓度与温度和pH的关系分别如下图所示:
4Fe(OH)3+8OH-+3O2。实验测得K2FeO4溶液浓度与温度和pH的关系分别如下图所示:


| X | | |
| | | Y |
 8W2Yn(l)。放电时,W+离子向___极移动;正极的电极反应式为________。
8W2Yn(l)。放电时,W+离子向___极移动;正极的电极反应式为________。 zC,恒温下,通过压缩容器体积改变压强,分别测得A的平衡浓度如下表:
zC,恒温下,通过压缩容器体积改变压强,分别测得A的平衡浓度如下表: