适用年级:{{getGradeNameByProperty('高三|月考试卷|福建|2012年')}} 试卷类型:{{getTestPaperTypeName('高三|月考试卷|福建|2012年')}} 使用省份:{{getAreaName('高三|月考试卷|福建|2012年')}}
试卷年份:{{getYear('高三|月考试卷|福建|2012年')}} 上传日期:2012-03-14 题数:12
题号:3297463
题型:选择题
难易度:一般
日期:2012-03-14
来源:2012届福建省福州八中高三第五次质量检测考试理科综合试卷(化学部分)
【题文】已知结构为正四面体型的离子A和直线型离子B反应,生成三角锥形分子C和V形分子D(A、B、C、D均为10电子微粒,组成它们的元素原子序数均小于10),下列说法正确的是
A.分子C与D不能发生化学反应
B.微粒A的空间结构与CH
4 相似,它们均为正四面体,所以A是非极性分子
C.固态D的熔沸点明显高于固态H
2 S的原因在于D分子中的共价键强于S-H键
D.在25℃时,A的盐酸盐溶液的pH小于7
题号:3297464
题型:选择题
难易度:一般
日期:2012-03-14
来源:2012届福建省福州八中高三第五次质量检测考试理科综合试卷(化学部分)
则下列判断正确的是
A.MFe2 Ox 是还原剂 B.SO2 是该反应的催化剂 C.x>y D.SO2 发生了置换反应
题号:3297465
题型:选择题
难易度:较易
日期:2012-03-14
来源:2012届福建省福州八中高三第五次质量检测考试理科综合试卷(化学部分)
【题文】下列说法正确的是
A.HCHO溶液、(NH4 )2 SO4 溶液均能使蛋白质变性 B.煤的干馏是物理变化,煤的气化和液化是化学变化 C.纤维素、蛋白质、油脂在一定条件下都能发生水解反应 D.分子式为CH4 O和C2 H6 O的物质一定互为同系物
题号:4339124
题型:选择题
难易度:一般
日期:2013-01-10
来源:2012届福建省福州八中高三第五次质量检测考试理科综合试卷(化学部分)
【题文】已知0.1 mol/L的碳酸氢钠溶液的pH为8.4,则下列说法正确的是
A.加入少量NaOH固体,钠离子和碳酸根离子浓度均增大 B.将该溶液加水稀释, C.c(Na+ )+c(H+ )=c(HCO3 - )+c(CO3 2 - )+c(OH- ) D.c(Na+ )=c(HCO3 - )+2c(CO3 2 - )+c(H2 CO3 )
题号:4339127
题型:选择题
难易度:
日期:2012-03-14
来源:2012届福建省福州八中高三第五次质量检测考试理科综合试卷(化学部分)
【题文】2011年是国际化学年,中国的宣传口号是“化学——我们的生活,我们的未来”。下列有关叙述错误的是
A.在家用燃煤中加入适量的生石灰能有效减少二氧化硫的排放量 B.大量排放SO2 或CO2 都会导致酸雨的形成 C.采用纳米二氧化钛光触媒技术,将汽车尾气中的NO和CO转化为无害气体 D.利用清洁能源如太阳能、潮汐能、风能来发电
题号:4339128
题型:选择题
难易度:
日期:2012-03-14
来源:2012届福建省福州八中高三第五次质量检测考试理科综合试卷(化学部分)
【题文】向明矾溶液中逐渐滴加Ba(OH)
2 溶液,符合要求的离子方程式为
A.加入过量的Ba(OH)2 溶液时:2Al3+ +3SO4 2- +3Ba2+ +6OH— = 2Al(OH)3 ↓+3BaSO4 ↓ B.溶液恰好呈中性时:2Al3+ +3SO4 2- +3Ba2+ +6OH— = 2Al(OH)3 ↓+3BaSO4 ↓ C.SO4 2 - 离子恰好完全沉淀时:Al3+ +SO4 2- +Ba2+ +4OH— = AlO2 - +BaSO4 ↓+2H2 O D.明矾与Ba(OH)2 按物质的量比1∶1反应时:Al3+ +SO4 2- +Ba2+ +3OH— = Al(OH)3 ↓+BaSO4 ↓
题号:4339129
题型:选择题
难易度:
日期:2012-03-14
来源:2012届福建省福州八中高三第五次质量检测考试理科综合试卷(化学部分)
【题文】有a克Na
2 CO
3 和NaHCO
3 混合物,下列实验方案中可测定其中Na
2 CO
3 质量分数的是
①将混合物与足量稀盐酸充分反应,逸出气体用碱石灰吸收,碱石灰增重b克
②将混合物充分加热,固体质量减少b克
③将混合物与足量BaCl
2 溶液充分反应,过滤、洗涤、烘干,得b克固体。
④将混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,碱石灰增重b克
题号:4339125
题型:实验题
难易度:一般
日期:2012-12-18
来源:2012届福建省福州八中高三第五次质量检测考试理科综合试卷(化学部分)
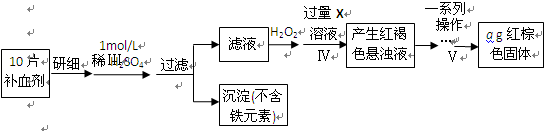
【题文】(17分) FeSO
4 ?7H
2 O广泛用于医药和工业领域。
以下是FeSO
4 ?7H
2 O的实验室制备流程图。
根据题意完成下列填空:
(1)碳酸钠溶液能除去酯类油污,是因为
(用离子方程式表示),反应Ⅰ需要加热数分钟,其原因是
。
(2)废铁屑中含氧化铁,无需在制备前除去,理由是
(用离子方程式回答)
,
。
(3)判断反应Ⅱ完成的现象是:
。
以下是测定某补血剂(FeSO
4 ?7H
2 O)中铁元素含量的流程图。根据题意完成下列填空:
(4)步骤Ⅲ需要100mL1mol/L的稀硫酸,用98.3%,ρ=1.84g/cm
3 的浓硫酸配制,所用的仪器有量筒、烧杯、玻璃棒、胶头滴管及
。写出步骤Ⅳ的离子方程式:
。
(5)步骤Ⅴ一系列操作依次是:①过滤②洗涤③
④冷却⑤称量⑥恒重操作。操作⑥的目的是
。
(6)假设实验无损耗,则每片补血剂含铁元素的质量
g(用含a的代数式表示)。
题号:3297461
题型:填空题
难易度:较难
日期:2012-03-14
来源:2012届福建省福州八中高三第五次质量检测考试理科综合试卷(化学部分)
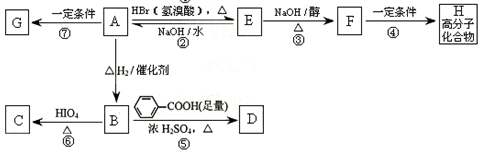
【题文】【化学—有机化学基础】(13分)
奶油中含有有一种可作香料的化合物A,A中只含C、H、O三种元素。通过红外光谱图分析可知A中含有碳氧双键;通过李比希法分析得到A分子中C、H、O原子个数比为2:4:1,通过质谱仪分析其相对分子质量为88。
已知:
与A相关的反应如下:
(1)A的分子式为
,H的结构简式为
。
(2)上述7步反应中属于取代反应的是
(填序号)。
(3)写出B → D反应的化学方程式:
。
(4)B的核磁共振氢谱图中共有
个峰。
(5)在空气中长时间搅拌奶油,A可转化为相对分子质量为86的化合物G。G有多种同分异构体,其中符合下列两个条件的同分异构体共有
种。
A.无环状结构 B.不含碳碳双键和碳碳叁键
题号:3297462
题型:填空题
难易度:较难
日期:2012-03-14
来源:2012届福建省福州八中高三第五次质量检测考试理科综合试卷(化学部分)
【题文】(14分)A、B、C、D、E 五种短周期主族元素分占三个周期,A、B、C为同一周期依次相邻的3种元素,A和C的原子序数之比为3∶4,E原子的电子层数等于最外层电子数,D的原子序数小于E。请用化学用语回答相关问题:
(1)A元素在周期表中的位置
。
(2)比较C和E简单离子半径大小:
。
(3)元素E的一种常见的可溶性盐溶液呈碱性,其原因是(用离子方程式表示):
;
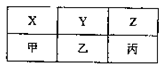
(4)X、Y、Z、甲、乙、丙是由A、B、C分别与D形成的化合物,六种化合物可以排成下表,其中同一横行的分子中电子数相同,同一纵行的物质所含元素种类相同,其中X、Y、甲常温常压下为气体,Z、乙、丙常温常压下为液体。
①甲的分子式为
;丙的电子式为
。
②乙的分子式为B
2 D
4 ,乙和丙常作火箭推进器的燃料,反应后的产物无污染。已知8g液态乙与足量液态丙完全反应,产物均为气体时,放出热量为160.35kJ,试写出该反应的热化学方程式:
。
题号:4339126
题型:填空题
难易度:一般
日期:2012-06-11
来源:2012届福建省福州八中高三第五次质量检测考试理科综合试卷(化学部分)
【题文】【化学——物质结构与性质】13分)
氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的价电子排布式是_________________。
(2)C、N、O三种元素第一电离能从大到小的顺序是____________。
(3)肼(N
2 H
4 )分子可视为NH
3 分子中的一个氢原子被-NH
2 (氨基)取代形成的另一种氮的氢化物。
①NH
3 分子的空间构型是_______________;N
2 H
4 分子中氮原子轨道的杂化类型是___________。
②肼可用作火箭燃料,燃烧时发生的反应是:
N
2 O
4 (l)+2N
2 H
4 (l)===3N
2 (g)+4H
2 O(g) △H=-1038.7kJ·mol
- 1 若该反应中有4mol N-H键断裂,则形成的π键有________mol。
③肼能与硫酸反应生成N
2 H
6 SO
4 。N
2 H
6 SO
4 晶体类型与硫酸铵相同,则N
2 H
6 SO
4 的晶体内不存在__________(填标号)
a. 离子键 b. 共价键 c. 配位键 d. 范德华力
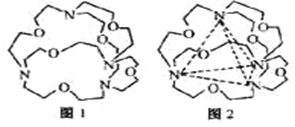
(4)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。
下列分子或离子中,能被该有机化合物识别的是_________(填标号)。
a. CF
4 b. CH
4 c. NH
4 + d. H
2 O
题号:4339130
题型:填空题
难易度:
日期:2012-03-14
来源:2012届福建省福州八中高三第五次质量检测考试理科综合试卷(化学部分)
【题文】(14分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产.生活中有着重要作用。请回答下列问题:
(1)用CH
4 催化还原NO
x 可以消除氮氧化物的污染。例如:
CH
4 (g) + 4NO
2 (g) = 4NO(g)+CO
2 (g) + 2H
2 O(g) ΔH
1 =-574 kJ·mol
- 1 CH
4 (g) + 4NO(g) =" 2" N
2 (g)+CO
2 (g) + 2H
2 O(g) ΔH
2 、 若1 mol CH
4 还原NO
2 至N
2 ,整个过程中放出的热量为867 kJ,则ΔH
2 =
;
(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H
+ )实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为:N
2 +3H
2 2NH
3 ,则在电化学合成氨的过程中,阴极反应式为
;
(3)在一定条件下,将l mol N
2 与3 mol H
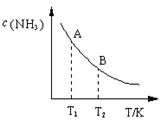
2 混合于一个10 L密闭容器中,反应达到平衡时,A点混合气体中氨占25%,试回答:
①A点时N
2 的浓度为
mol/L;
②右图中在状态A时,平衡常数 K
A =
(填写代入数值的表达式,不要求化简);当温度由T
1 变化到T
2 时,K
A K
B (填“>”、“<”或“=”)。
③在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
时间/min—1 c (N2 ) c (H2 ) c (NH3 ) 0 0.6 1.8 0 3 0.52 x 0.16 6 0.36 1.08 0.48 9 0.36 1.08 0.48
反应从0 min到3 min之间,H
2 的反应速率为
;反应在3 min时,条件发生了改变,改变的条件可能是
(填序号)。
a.使用催化剂 b.降低温度 c.增加H
2 的浓度 d.充入Ne增大压强

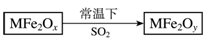
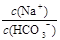 的比值保持不变
的比值保持不变 和NaHCO3混合物,下列实验方案中可测定其中Na2CO3质量分数的是
和NaHCO3混合物,下列实验方案中可测定其中Na2CO3质量分数的是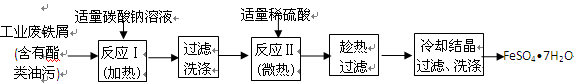
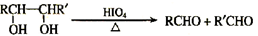
 2NH3,则在电化学合成氨的过程中,阴极反应式为 ;
2NH3,则在电化学合成氨的过程中,阴极反应式为 ;