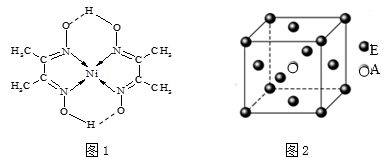
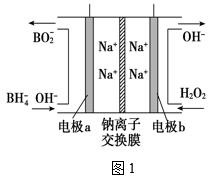
| A.①中阴极处能产生使湿润淀粉KI试纸变蓝的气体 |
| B.②中待镀铁制品应与电源正极相连 |
| C.③中钢闸门应与外接电源的正极相连 |
| D.④中的离子交换膜可以避免生成的Cl2与NaOH溶液反应 |
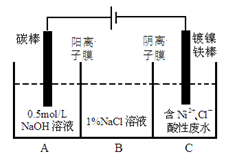
| A.第一电离能:③>②>① |
| B.原子半径:③>②>① |
| C.电负性:③>②>① |
| D.最高正化合价:③>②>① |
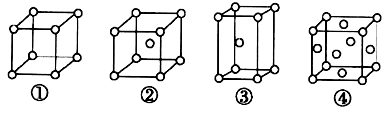
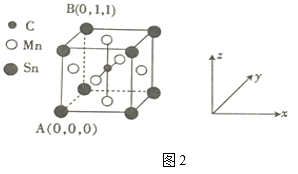
| A.①为简单立方堆积②为六方最密堆积③为体心立方堆积④为面心立方最密堆积 |
| B.每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个 |
| C.晶胞中原子的配位数分别为:①6,②8,③8,④12 |
| D.空间利用率的大小关系为:①<②<③<④ |
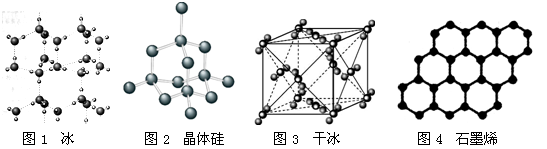
| A.18g冰(图1)中含O—H键数目为2NA |
| B.28g晶体硅(图2)中含有Si—Si键数目为2NA |
| C.44g干冰(图3)中含有NA个晶胞结构单元 |
| D.石墨烯(图4)是碳原子单层片状新材料,12g石墨烯中含C—C键数目为1.5NA |
 eC(g)+fD(g),反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如下图。下列叙述正确的是
eC(g)+fD(g),反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如下图。下列叙述正确的是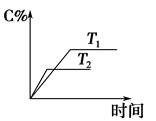 图Ⅱ
图Ⅱ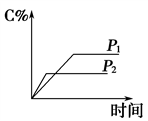
| A.化学方程式中m+n<e+f |
| B.达平衡后,若升温,平衡左移 |
| C.达平衡后,加入催化剂则C%增大 |
| D.达平衡后,增加A的量有利于平衡向右移动 |
 Al2O3+3H2↑
Al2O3+3H2↑| | 电池 | 电解池 |
| A | H+移向Pb电极 | H+移向Pb电极 |
| B | 每消耗3mol Pb | 生成2mol Al2O3 |
| C | 正极:PbO2+4H++2e-═Pb2++2H2O | 阳极:2Al+3H2O-6e-═Al2O3+6H+ |
| D |  |  |
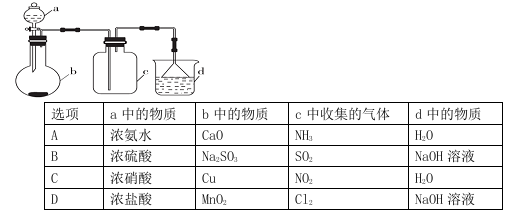
| A.A | B.B | C.C | D.D |
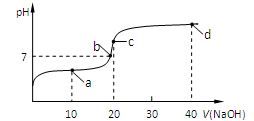
| A.a点时:c(CH3COOH) >c(Na+)>c(CH3COO-)>c(H+) >c(OH-) |
| B.b点时:c(Na+)=c(CH3COO-) |
| C.c点时:c(OH-)=c(CH3COOH)+ c(H+) |
| D.d点时:c(Na+) > c(CH3COO-)>c(OH-) >c(H+) |
| A.它们均由甲烷去掉一个氢原子所得 |
| B.它们互为等电子体,碳原子均采取sp3杂化 |
| C.CH3-与NH3、H3O+互为等电子体,几何构型均为三角锥形 |
| D.以CH3+中的碳原子采取sp3杂化,所有原子均共面 |
| | A | B | C | D |
| 实验方案 | 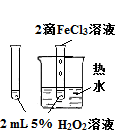 | 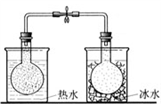 将NO2球浸泡在冰水和热水中 | 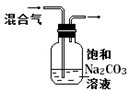 | 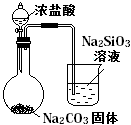 |
| 实验 目的 | 验证FeCl3对H2O2分解反应有催化作用 | 探究温度对平衡 2NO2  N2O4的影响 N2O4的影响 | 除去CO2气体中混有的SO2 | 比较HCl、H2CO3和H2SiO3的酸性强弱 |
A.某温度Ksp(Ag2S)=6 10-50(mol·L-1)3,Ksp(AgCl)=2 10-50(mol·L-1)3,Ksp(AgCl)=2 10-6(mol·L-1)2,则2AgCl(g)+S2-(aq) 10-6(mol·L-1)2,则2AgCl(g)+S2-(aq)  Ag2S(s)+2Cl-(aq)的平衡常数约为6.7 Ag2S(s)+2Cl-(aq)的平衡常数约为6.7 1037mol·L-1 1037mol·L-1 |
| B.pH相同的①CH3COONa ②NaHCO3 ③NaClO三种溶液中c(Na+):③<②<① |
| C.pH=a的氨水溶液,稀释10倍后,其pH=b,则b<a-1 |
| D.一定浓度的NaHS溶液在:c(Na+)+c(OH-)=c(H+)+c(HS-)+2c(H2S) |
 N2O5(g)+O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0 mol NO2和1.0 mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
N2O5(g)+O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0 mol NO2和1.0 mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:| t/s | 0 | 3 | 6 | 12 | 24 |
| n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
| A.常温下水电离出的c(H+)=1×10-10 mol•L-1的溶液中:Na+、Cl-、S2-、SO32- |
| B.不能使酚酞试液变红的无色溶液中:Na+、CO32-、ClO-、Al3+ |
| C.能与金属铝反应放出氢气的溶液中:K+、CO32-、Cl-、NH4+ |
| D.无色透明溶液:K+、HCO3-、SO42-、Fe3+ |
 Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表:| 温度/℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
 Ni(s)+4CO(g)的平衡常数为2×10-5 (mol·L-1)3
Ni(s)+4CO(g)的平衡常数为2×10-5 (mol·L-1)3| A.反应 TiO2(s)+2Cl2(g) = TiCl4(g) +O2(g) △H>0能自发进行,其原因是△S>0 |
| B.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)⇌2NH3(g)△H=-38.6kJ•mol-1 |
| C.0.5mol H2SO4与0.5mol Ba(OH)2反应生成1 mol H2O时的反应热叫中和热 |
| D.已知H﹣H键能436 kJ•mol﹣1,F﹣F键能157 kJ•mol﹣1,H﹣F键能568 kJ•mol﹣1,则H2(g)+F2(g)=2HF(g) △H=﹣25 kJ•mol﹣1 |
| A.△H3不是H2(g)的燃烧热 |
| B.联氨和N2O4反应放热多、产生气体多,因此可作火箭推进剂 |
| C.△H4 = 2△H3 - 2△H2 - △H1 |
| D.若联氨为气态,则△H4 大于-1048.9 kJ∙mol-1 |
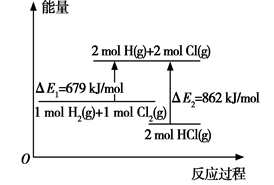
| A.ΔE1是该反应的活化能 |
| B.ΔE2是2 mol H—Cl键的总键能 |
| C.加入催化剂可以改变反应的焓变 |
| D.该反应是一个放热反应 |
| A.某金属元素气态基态原子的逐级电离能的数值分别为738、1451、7733、10540、13630、17995、21703……,当它与氯气反应时生成的阳离子是X2+ |
| B.熔沸点:金刚石>纯铁>生铁>干冰 |
| C.熔融状态的HgCl2不能导电,HgCl2的稀溶液有弱的导电能力且可作手术刀的消毒液,从不同角度分类HgCl2是一种共价化合物、非电解质、盐、离子晶体; |
| D.含极性键的非极性分子往往是高度对称的分子,比如CO2、BF3、CH4这样的分子 |
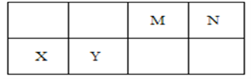
| A.基态Y原子中存在6种能量不同的电子 |
| B.X位于第三周期IIA ,其单质可采用电解熔融其氯化物制备 |
| C.元素最高价氧化物的水化物中,酸性最强的是HNO3 |
D.气体分子(MN)2的电子式为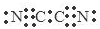 |
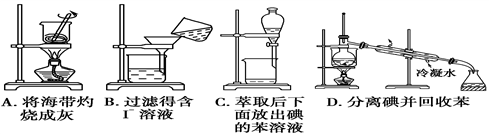
| A.A | B.B | C.C | D.D |

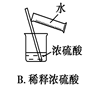
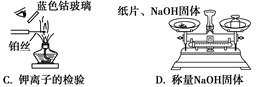
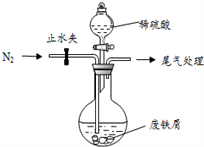
| A.A | B.B | C.C | D.D |
| 选项 | 物质(括号中为杂质) | 除杂试剂 | 分离方法 |
| A | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| B | 硝酸钾(NaCl) | 水 | 降温结晶 |
| C | 淀粉(NaCl) | 水 | 渗析 |
| D | NaCl溶液(Na2S) | AgCl | 过滤 |
| A.②③⑥ | B.①④⑤ | C.①⑤⑥ | D.②③④ |

 COCl2(g) ΔH ="a" kJ/mol反应过程中测定的部分数据如下表:
COCl2(g) ΔH ="a" kJ/mol反应过程中测定的部分数据如下表:

 2CO2(g)+N2(g) ΔH=-748 kJ·mol-1
2CO2(g)+N2(g) ΔH=-748 kJ·mol-1
 CH3OCH3(g)+H2O(g) △H<0
CH3OCH3(g)+H2O(g) △H<0| A.υ(H2)=2υ(CO) | B.容器内的压强不变 |
| C.混合气体的密度不变 | D.混合气体的平均相对分子质量不变 |