适用年级:{{getGradeNameByProperty('高三|月考试卷|福建|2011年')}} 试卷类型:{{getTestPaperTypeName('高三|月考试卷|福建|2011年')}} 使用省份:{{getAreaName('高三|月考试卷|福建|2011年')}}
试卷年份:{{getYear('高三|月考试卷|福建|2011年')}}上传日期:2011-11-22题数:19
提示:单击题文可显示答案与解析。
题号:3307750
题型:选择题
难易度:一般
日期:2011-11-22
来源:2012届福建省厦门外国语学校高三上学期10月份月考化学试卷
【题文】一定条件下,用甲烷可以消除氮氧化物(NO
x)的污染。已知:
① CH
4 (g)+4NO
2 (g)="4NO" (g) +CO
2 (g)+2H
2O (g) ;
△H=―574 kJ·mol
-1 ② CH
4 (g)+4NO (g)=2N
2 (g)+CO
2 (g)+2H
2O (g) ;
△H=―1160 kJ·mol
一1。
下列选项正确的是( )
| A.CH4 (g)+2NO2 (g)= N2 (g)+CO2 (g)+2H2O (l) ;△H=―867 kJ·mol-1 |
| B.若0.2 mol CH4还原NO2至N2,在上述条件下放出的热量为173.4 kJ |
| C.CH4催化还原NOx为N2的过程中,若x=1.6,则转移的电子为3.2 mol |
| D.若用标准状况下2.24L CH4还原NO2至N2,整个过程中转移的电子为1.6 mol |
题号:3307751
题型:选择题
难易度:一般
日期:2011-11-22
来源:2012届福建省厦门外国语学校高三上学期10月份月考化学试卷
【题文】某温度下反应N
2O
4(g)

2NO
2 (g);Δ
H>0,在密闭容器中达平衡,下列说法正确的是( )
| A.保持体积不变,加入少许N2O4,平衡向逆反应方向移动 |
| B.升高温度v正、v逆都增大,v正增大的倍数小于v逆增大的倍数 |
| C.保持体积不变,升高温度,再达平衡时混和气体颜色变深 |
| D.达到平衡后,降低温度或减小压强平衡移动的方向一致 |
题号:3307752
题型:选择题
难易度:一般
日期:2011-11-22
来源:2012届福建省厦门外国语学校高三上学期10月份月考化学试卷
【题文】在一密闭容器中有如下反应:L (s) + a G (g)

b R (g) 温度和压强对该反应的影响如右图所示。
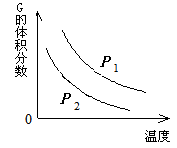
其中压强
P1 <
P2,由此可判断( )
| A.正反应为放热反应 |
| B.化学方程式中的计量数a>b |
| C. G的转化率随温度升高而减小 |
| D.增大压强,容器内气体质量不变 |
题号:3307753
题型:选择题
难易度:一般
日期:2011-11-22
来源:2012届福建省厦门外国语学校高三上学期10月份月考化学试卷
【题文】定温度、压强和有铁触媒的条件下,在密闭容器中充入N
2、H
2和NH
3 。若起始时n(N
2)="x" mol、n(H
2)="y" mol、n(NH
3)="z" mol (x、y、z均不为0 ),平衡时,n(N
2)=0.1mol、n(H
2)=0.3mol、n(NH
3)=0.08mol。下列有关判断不合理的是( )
| A.x : y ="1" : 3 |
| B.N2、H2的转化率不相等 |
| C.平衡时,H2与NH3的生成速率之比为3 : 2 |
| D.x的取值范围为0<x<0.14 |
题号:3307754
题型:选择题
难易度:一般
日期:2011-11-22
来源:2012届福建省厦门外国语学校高三上学期10月份月考化学试卷
【题文】反应2H
2CrO
4+3H
2O
2=2Cr(OH)
3+3O
2↑+2H
2O,下列说法正确的是( )
| A.H2CrO4是氧化剂,H2O是氧化产物 |
| B.若3mol H2O2完全反应,则反应中共转移了6NA个电子 |
| C.还原剂与氧化剂的质量比是1:2[M(H2CrO4)=118,M(H2O2)=34] |
| D.氧化产物和还原产物的物质的量之比为2:3 |
题号:3307755
题型:选择题
难易度:一般
日期:2011-11-22
来源:2012届福建省厦门外国语学校高三上学期10月份月考化学试卷
【题文】镁——H
2O
2酸性电池采用海水作电解质(加入一定量酸),下列说法正确的是( )
| A.电池总反应为Mg+H2O2+2H+=Mg2++ 2H2O |
| B.负极反应为H2O2+2e-+ 2H+= 2H2O |
| C.电池工作时,正极周围海水的pH减小 |
| D.电池工作时,溶液中的H+向负极移动 |
题号:3307756
题型:选择题
难易度:一般
日期:2011-11-22
来源:2012届福建省厦门外国语学校高三上学期10月份月考化学试卷
【题文】下列有关工业生产的叙述正确的是( )
| A.合成氨生产过程中将NH3液化分离,可提高N2、H2的转化率 |
| B.硫酸工业中,为了提高SO2的转化率,用五氧化二钒作催化剂, |
| C.电解饱和食盐水制烧碱采用离子交换膜法,可防阴极室产生的C12进入阳极室 |
| D.电解精炼铜时,同一时间内阳极溶解铜的质量和阴极析出铜的质量相同 |
题号:3307757
题型:选择题
难易度:一般
日期:2011-11-22
来源:2012届福建省厦门外国语学校高三上学期10月份月考化学试卷
【题文】下列叙述正确的是( )
| A.粗铜精炼时,把粗铜接在电源的负极 |
| B.充电时,把铅蓄电池的负极接在外电源的正极 |
| C.镀锡铁破损后铁更易被腐蚀 |
D.碱性氢氧燃料电池工作时,负极反应为: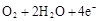 = =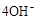 |
题号:4311464
题型:选择题
难易度:一般
日期:2014-10-13
来源:2012届福建省厦门外国语学校高三上学期10月份月考化学试卷
【题文】足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO
2、N
2O
4、NO的混合气体,这些气体与1.68 L O
2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L
-1 NaOH溶液至Cu
2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
| A.60 mL | B.45 mL | C.30 mL | D.15 mL |
题号:4336822
题型:选择题
难易度:一般
日期:2012-05-07
来源:2012届福建省厦门外国语学校高三上学期10月份月考化学试卷
【题文】已知反应N
2(g)+3H
2(g)
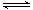
2NH
3(g);Δ
H<0,向某体积恒定的密闭容器中按体积比1:3充入N
2和H
2,在一定条件下发生反应。右图是某物理量(
Y)随时间(
t)变化的示意图(图中T表示温度),
Y可以是
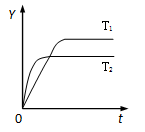
| A.N2的转化率 | B.混合气体的密度 |
| C.密闭容器的压强 | D.H2的体积分数 |
题号:4347629
题型:选择题
难易度:一般
日期:2011-11-22
来源:2012届福建省厦门外国语学校高三上学期10月份月考化学试卷
题号:4347630
题型:选择题
难易度:一般
日期:2011-11-22
来源:2012届福建省厦门外国语学校高三上学期10月份月考化学试卷
【题文】根据下列热化学方程式
(1)C(s) + O
2(g) = CO
2(g) △H
1=–393.5 kJ/mol
(2)H
2(g) +
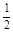
O
2(g) =2H
2O(l) △H
2=–285.8 kJ/mol
(3)CH
3COOH(l) +2O
2(g)=2CO
2 (g) + 2H
2O(l) △H
3=–870.3kJ/mol
可以计算出2C(s) + 2H
2(g)+ O
2(g)=CH
3COOH(l)的反应热为( )
| A.△H=+244.1kJ/mol | B.△H =-488.3kJ/mol |
| C.△H=-996.6kJ/mol | D.△H =+996.6kJ/mol kJ/mol |
题号:4347631
题型:选择题
难易度:一般
日期:2012-09-28
来源:2012届福建省厦门外国语学校高三上学期10月份月考化学试卷
【题文】有下列三个反应:①Cl
2 + FeI
2 = FeCl
2 + I
2 ②2Fe
2+ + Br
2 = 2Fe
3+ + 2Br
-③Co
2O
3 + 6HCl = 2CoCl
2 + Cl
2↑+ 3H
2O ,下列说法正确的是( )
| A.①②③中的氧化产物分别是FeCl2 、Fe3+、Cl2 |
| B.根据以上方程式可以得到氧化性Cl2 > Co2O3 >Fe3+ |
| C.在反应③中生成1mol Cl2时,有2molHCl被氧化 |
| D.根据反应①②一定可以推理得到Cl2 + FeBr2 = FeCl2 +Br2 |
题号:4347633
题型:选择题
难易度:
日期:2011-11-22
来源:2012届福建省厦门外国语学校高三上学期10月份月考化学试卷
【题文】下列叙述中,正确的是( )
| A.含最高价元素的化合物,一定具有强氧化性 |
| B.阳离子只有氧化性,阴离子只有还原性 |
| C.失电子越多,还原能力越强 |
| D.强氧化剂与强还原剂不一定都能发生氧化还原反应 |
题号:4347635
题型:实验题
难易度:
日期:2011-11-22
来源:2012届福建省厦门外国语学校高三上学期10月份月考化学试卷
【题文】(13分)近年来,江苏省酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
⑴有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,流程如下: ( I )将含SO
2的废气通入电解饱和食盐水所得溶液中,得NaHSO
3溶液。(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸。(III)将盐酸加入NaHSO
3溶液中得SO
2气体回收,生成的NaCl循环利用。
①写出步骤(I)反应的化学方程式:
②写出步骤(III)反应的离子方程式:
⑵还有学者提出利用 Fe
2十、Fe
3十等离子的催化作用,常温下将SO
2氧化成SO
42一而实现SO
2的回收利用。某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO
2氧化成SO
42一的转化率。
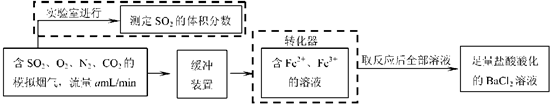
①该小组采用下图装置在实验室测定模拟烟气中SO
2的体积分数,X溶液可以是(填序号)
。(参考:还原性SO
2> I
- >Br
->Cl
-)
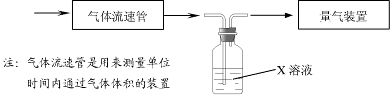
| A.碘的淀粉溶液 | B.酸性高锰酸钾溶液 |
| C.氢氧化钠溶液 | D.氯化钡溶液 |
②若上述实验是在标准状况下进行的,X是已知体积和物质的量浓度的溶液,欲测定转化器中SO
2氧化成SO
42一的转化率,已知气体流速,还需测定的数据是
和加入盐酸酸化的氯化钡溶液后生成沉淀的质量。
(3)新型氨法烟气脱硫技术采用氨吸收烟气中SO
2生成亚硫酸铵和亚硫酸氢铵,再用一定量的磷酸进行反应,在反应回收SO
2后的混合物中通入适量的氨气得到一种产品。该技术的优点是
。
(4)为进一步减少SO
2的

污染并变废为宝,人们正在探索用CO还原SO
2得到单质硫的方法来除去SO
2。该方法涉及到的化学反应为:SO
2+2CO=2CO
2+
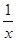
S
x 、
CO+
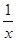
S
x=COS、2COS+SO
2=2CO
2+
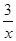
S
x 。其中COS中“C”化合价为
。
(5)若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在消化细菌的作用下将
NH
4+氧化为NO
3-:NH
4++2O
2=NO
3-+2H
++H
2O,然后加入甲醇【CH
3OH】,NO
3-和甲醇转化为两种无毒气体。请写出加入甲醇后反应的离子方程式
。
题号:3307747
题型:填空题
难易度:容易
日期:2011-11-22
来源:2012届福建省厦门外国语学校高三上学期10月份月考化学试卷
【题文】(12分)黄铁矿(主要成分为FeS
2)是工业制取硫酸的重要原料,其煅烧产物为SO
2和Fe
3O
4。
(1)将0.050 mol SO
2(g)和0.030 mol O
2(g)放入容积为1 L的密闭容器中,反应
2SO
2(g)+O
2(g)

2SO
3(g)在一定条件下达到平衡,测得
c(SO
3)=0.040 mol/L。则该条件下反应的平衡常数
K=
,SO
2的平衡转化率=
。
(2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO
2平衡转化率的有
(填字母)
| A.升高温度 | B.降低温度 | C.增大压强 |
| D.减小压强 (E)加入催化剂 (G)移出氧气 |
(3)SO
2尾气用饱和Na
2SO
3溶液吸收可得到重要的化工原料,反应的化学方程式为________________________________________________________________。
(4)将黄铁矿的煅烧产物Fe
3O
4溶于H
2SO
4后,加入铁粉,可制备FeSO
4。酸溶过程中需保持溶液足够酸性,其原因是______________________。
题号:3307748
题型:填空题
难易度:较易
日期:2011-11-22
来源:2012届福建省厦门外国语学校高三上学期10月份月考化学试卷
【题文】(8分)微生物燃料电池(MFC)是燃料电池中特殊的一类,它利用微生物作为反应主体,将有机物的化学能转化为电能。以葡萄糖溶液作底物为例,其工

作原理如右图所示。
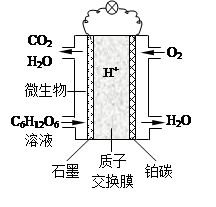

已知石墨电极上反应为:
C
6H
12O
6+6H
2O-24e
- 6CO
2+24H
+⑴ 电池中的质子交换膜只允许质子和水分子通过。电池工作时,质子移向电源的
极,铂碳上所发生的电极反应式为_____________。
⑵燃烧热是指1摩尔物质完全燃烧生成稳定的物质(如H转化为液态水,C转化为二氧化碳 )所放出的热量。葡萄糖的燃烧热为2800kJ/mol,写出葡萄糖燃烧的热化学方程式
。
⑶ 化学需氧量(COD)是重要的水质指标,其数值表示将1L水中的有机物氧化为CO
2、H
2O所需消耗的氧气的质量。科学家设想利用微生物燃料电池来处理某些污水,并进行发电,该设想已经在实验室中获得成功。但如果1L废水中有机物(折算成葡萄糖)氧化提供的化学能低于5.6kJ,就没有发电的必要。则下列污水中,不适合用微生物燃料电池发电的是
(填序号)。
序号
| A
| B
| C
| D
| E
|
污水类型
| 生活污水
| 印染
| 电镀
| 造纸
| 硫酸工业废水
|
COD值(mg/L)
| 520
| 870
| 20
| 960
| 120
|
题号:3307749
题型:填空题
难易度:一般
日期:2011-11-22
来源:2012届福建省厦门外国语学校高三上学期10月份月考化学试卷
【题文】(10分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
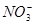
+4H
++3e
-=NO+2H
2O 。 已知Cu
2O能使上述还原过程发生。
(1)写出并配平该氧化还原反应的化学方程式:______________
。
(2)反应中硝酸体现了________、_________的性质。
(3)反应中若产生0.2 mol气体,则转移电子的物质的量是___________mol。
(4)若1 molCu
2O与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是__________

_。
题号:4347634
题型:填空题
难易度:
日期:2011-11-22
来源:2012届福建省厦门外国语学校高三上学期10月份月考化学试卷
【题文】(12分)合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为:N
2(g)+3H
2(g)

3NH
3(g) ,△H=-92.2kJ/mol。合成氨工业中原料气N
2可从空气中分离得到,H
2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。回答下列问题:
(1) 合成氨工业中原料气压缩到30~50MPa的原因是

。从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是
。
(2) 500℃、50MPa时,在容积为VL的容器中加入n mol N
2、3n mol H
2,反应达平衡后测得平衡常数为K
1,此时N
2的转化率为x。则K
1和x的关系满足K
1=
。若温度为400℃,平衡常数为K
2,则K
1 K
2(填“<”、“=”或“>” )
(3) 甲烷在高温下与水蒸气反应的热化学反应方程式为:
CH
4(g)+H
2O(g)=CO(g)+3H
2(g); △H kJ·mol
-1。
又已知: H
2(g) +1/2 O
2(g)="=" H
2O(l); △H
1=-285.8kJ/mol
CO(g) + 1/2 O
2(g)=CO
2(g) ;△H
2=-283.0kJ/mol
CH
4(g) +2 O
2(g)="=" CO
2(g) + 2H
2O(l); △H
3=-890.3kJ/mol
H
2O(g) ="=" H
2O(l); △H
4=-44.0kJ/mol
①写出H
2(g)完全燃烧生成气态水的热化学方程式
。
② CH
4(g)+H
2O(g)=CO(g)+3H
2(g); △H=
kJ/mol
 2NO2 (g);ΔH>0,在密闭容器中达平衡,下列说法正确的是( )
2NO2 (g);ΔH>0,在密闭容器中达平衡,下列说法正确的是( ) b R (g) 温度和压强对该反应的影响如右图所示。
b R (g) 温度和压强对该反应的影响如右图所示。
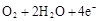 =
=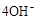
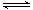 2NH3(g);ΔH<0,向某体积恒定的密闭容器中按体积比1:3充入N2和H2,在一定条件下发生反应。右图是某物理量(Y)随时间(t)变化的示意图(图中T表示温度),Y可以是
2NH3(g);ΔH<0,向某体积恒定的密闭容器中按体积比1:3充入N2和H2,在一定条件下发生反应。右图是某物理量(Y)随时间(t)变化的示意图(图中T表示温度),Y可以是
 2SO3
2SO3 CO2 + H2
CO2 + H2 H2CO3
H2CO3 Fe(SCN)3
Fe(SCN)3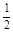 O2(g) =2H2O(l) △H2=–285.8 kJ/mol
O2(g) =2H2O(l) △H2=–285.8 kJ/mol

 污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2。该方法涉及到的化学反应为:SO2+2CO=2CO2+
污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2。该方法涉及到的化学反应为:SO2+2CO=2CO2+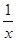 Sx 、
Sx 、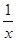 Sx=COS、2COS+SO2=2CO2+
Sx=COS、2COS+SO2=2CO2+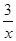 Sx 。其中COS中“C”化合价为 。
Sx 。其中COS中“C”化合价为 。 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。则该条件下反应的平衡常数K= ,SO2的平衡转化率= 。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。则该条件下反应的平衡常数K= ,SO2的平衡转化率= 。 作原理如右图所示。
作原理如右图所示。
 已知石墨电极上反应为:
已知石墨电极上反应为: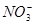 +4H++3e-=NO+2H2O 。 已知Cu2O能使上述还原过程发生。
+4H++3e-=NO+2H2O 。 已知Cu2O能使上述还原过程发生。 _。
_。 3NH3(g) ,△H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。回答下列问题:
3NH3(g) ,△H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。回答下列问题: 。从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是 。
。从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是 。