适用年级:{{getGradeNameByProperty('高二|月考试卷|福建|2018年')}} 试卷类型:{{getTestPaperTypeName('高二|月考试卷|福建|2018年')}} 使用省份:{{getAreaName('高二|月考试卷|福建|2018年')}}
试卷年份:{{getYear('高二|月考试卷|福建|2018年')}} 上传日期:2018-06-27 题数:11
题号:3146431
题型:选择题
难易度:较难
日期:2016-04-14
来源:【全国百强校】福建省厦门外国语学校2017-2018学年高二6月月考化学试题
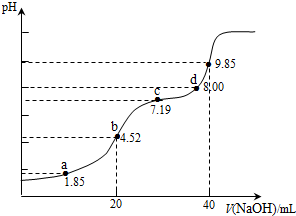
【题文】已知:pKa=-lgKa,25℃时,H
2 SO
3 的 pKa
1 =1.85,pKa
2 =7.19.用0.1mol•L
-1 NaOH溶液滴定20mL0.1mol•L
-1 H
2 SO
3 溶液的滴定曲线如图所示(曲线上的数字为pH).下列说法不正确的是( )
A.a点所得溶液中:2c(H2 SO3 )+c(SO3 2- )<0.1 mol•L-1 B.b点所得溶液中:c(H2 SO3 )+c(H+ )=c(SO3 2- )+c(OH- ) C.c点所得溶液中:c(Na+ )<3c(HSO3 − D.d点所得溶液中:c(Na+ )>c(SO3 2- )>c(HSO3 - )
题号:6102427
题型:选择题
难易度:较易
日期:2018-01-16
来源:【全国百强校】福建省厦门外国语学校2017-2018学年高二6月月考化学试题
【题文】《天工开物》膏液篇,关于提取油脂有如下的叙述,“若水煮法,则并用两釜。将蓖麻、苏麻子碾碎,入一釜中,注水滚煎,其上浮沫即油”。此文中涉及到的下列操作是
题号:6102428
题型:选择题
难易度:较难
日期:2018-01-09
来源:【全国百强校】福建省厦门外国语学校2017-2018学年高二6月月考化学试题
【题文】能正确表示下列反应的离子方程式是
A.磁性氧化铁溶于稀硝酸:3Fe2+ +4H+ +NO3 - =3Fe3+ +NO↑+3H2 O B.向Na2 SiO3 溶液中通入过量SO2 :SiO3 2- +SO2 +H2 O=H2 SiO3 ↓+SO3 2- C.NaHSO4 溶液与Ba(OH)2 溶液反应,当SO4 2- 完全沉淀时: H+ +SO4 2- +OH- +Ba2+ =BaSO4 ↓+H2 O D.己知电离平衡常数: H2 CO3 >HClO>HCO3 - ,向NaClO溶液中通入少量CO2 :2ClO- +CO2 +H2 O=2HClO+CO3 2-
题号:6102429
题型:选择题
难易度:一般
日期:2017-12-14
来源:【全国百强校】福建省厦门外国语学校2017-2018学年高二6月月考化学试题
【题文】室温时,下列各溶液的叙述中正确的是
A.将AgCl与AgBr的饱和溶液等体积混合,再加入足量的浓AgNO3 溶液,析出的AgCl沉淀少于AgBr沉淀 B.已知酸性:HF>CH3 COOH,pH相等的NaF与CH3 COOK溶液中:[c(Na+ )-c(F- )]<[c(K+ )-c(CH3 COO- ) ] C.0.1mol/L的氨水的pH=a,0.01mol/L的氨水的pH=b,则a-1>b D.0.10mol·L- 1 CH3 COONa溶液中通入HCl至溶液的pH恰好等于7,则c(Na+ )>c(CH3 COOH)=c(Cl- )
题号:6102430
题型:选择题
难易度:较难
日期:2018-05-02
来源:【全国百强校】福建省厦门外国语学校2017-2018学年高二6月月考化学试题
【题文】三元电池成为2018年我国电动汽车的新能源,其电极材料可表示为
,且x+y+z=1.充电时电池总反应为LiNi
x Co
y Mn
z O
2 +6C(石墨)= Li
1-a Ni
x Co
y Mn
z O
2 +Li
a C
6 ,其电池工作原理如图所示,两极之间有一个允许特定的离子X通过的隔膜。下列说法正确的是
A.允许离子X通过的隔膜属于阴离子交换膜 B.充电时,A 为阴极,Li+ 被氧化 C.可从无法充电的废旧电池的石墨电极中回收金属锂 D.放电时,正极反应式为 Li1-a Nix Coy Mnz O2 +aLi + +ae- = LiNix Coy Mnz O2
题号:6102431
题型:选择题
难易度:一般
日期:2018-01-09
来源:【全国百强校】福建省厦门外国语学校2017-2018学年高二6月月考化学试题
【题文】下列根据实验操作和现象所得出的结论不正确的是
选项 实验操作 实验现象 结论 A 在A1C13 溶液中逐滴滴入NaOH溶液至过量,然后通入CO2 气体 先出现白色沉淀,后沉淀消失,最后又出现白色沉淀 Al(OH)3 是两性氢氧化物,但不能溶解在某些弱酸中 B 向浓度均为0.1mol/L的MgCl2 、 CuCl2 混合溶液中逐滴加入氨水 先出现蓝色沉淀 Ksp [Mg(OH)2 ]>Ksp [Cu(OH)2 ] C 向Na2 CO 3 溶液中加入浓盐酸,将产生的气体通入硅酸钠溶液中 产生白色浑浊 酸性:盐酸>碳酸>硅酸 D 向盛有KI3 溶液的两试管中分别加入淀粉溶液和AgNO3 溶液 前者溶液变蓝色,后者有黄色沉淀 KI3 溶液中存在I3 - 2 +I- 平衡
A. A B. B C. C D. D
题号:6102432
题型:选择题
难易度:一般
日期:2018-03-31
来源:【全国百强校】福建省厦门外国语学校2017-2018学年高二6月月考化学试题
【题文】为测定某草酸晶体(H
2 C
2 O
4 •2H
2 O)样品的纯度,现称取一定质量的该样品,配制成100 mL溶液,取25.00 mL该溶液于锥形瓶中,加适量稀硫酸,用0.100 mol/L的KMnO
4 溶液滴定(杂质不参与反应)。为省去计算过程,当称取的样品的质量为某数值时,滴定所用KMnO
4 溶液的毫升数恰好等于样品中草酸晶体的质量分数的100倍。则应称取样品的质量为
A.2.25 g B.3.15 g C.9.00 g D.12.6 g
题号:6102433
题型:实验题
难易度:一般
日期:2018-05-02
来源:【全国百强校】福建省厦门外国语学校2017-2018学年高二6月月考化学试题
【题文】氯化亚砜(SOCl
2 )是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛。SOCl
2 遇水剧烈反应、产生白雾和带有制激性气味的气体。实验室合成SOCl
2 的原理为:SO
2 +Cl
2 +SCl
2 2SOCl
2 ,部分装置如图所示。
回答下列问题:
(1)仪器a 的名称是_______,装置b 的作用是__________。
(2)实验室制取SOCl
2 时,所选仪器的连接顺序是⑥→______→①②←_____(某此仪器可以多次使用)。
(3)冷凝管口③是_____(填“进水”或“出水”)口,本实验中制备氯气的离子方程式为___________。
(4)将SOCl
2 与AlCl
3 ·6H
2 O混合加热,可得到无水AlCl
3 ,试解释原因________。
(5)已知SCl
2 的沸点为50℃。实验结束后,将三颈烧瓶中的混合物分离开的实验操作名称是___。若反应中消耗标准状况下的Cl
2 的体积为1120 mL,最后得到纯净的SOCl
2 6.76 g,则SOCl
2 的产率为________(保留三位有效数字)。
(6) 已知:SOCl
2 +4NaOH= Na
2 SO
3 +2NaCl +2H
2 O。请设计简单的实验( 可选试剂:稀盐酸、稀硝酸、氯化钡溶液、硝酸钡溶液、硝酸银溶液、品红溶液) 来验证氯化亚砜与NaOH 溶液反应后的溶液中存在Cl
- __________________。
题号:3620623
题型:简答题
难易度:较难
日期:2017-05-06
来源:【全国百强校】福建省厦门外国语学校2017-2018学年高二6月月考化学试题
【题文】氢能被视为21世纪最具发展潜力的清洁能源,其开发利用是科学家们研究的重要课题。试回答下列问题:
(1)与化石燃料相比,氢气作为燃料的优点是_________(至少答出两点)。
(2)与氢气直接燃烧相比较,设计成镍氢电池可以大大提高能量的转换率,在镍氢电池充电过程中储氢合金(M)吸氢转化为MH
2 ,总反应为:xNi(OH)
2 +M
xNiOOH+MH
x ,试写出放电过程中负极
反应式____________。
(3)施莱辛(Sehlesinger)等人提出可用NaBH
4 与水反应制氢气:BH
4 - +2H
2 O=BO
2 - +4H
2 ↑,已知NaBH
4 与水反应后所得溶液显碱性,溶液中各离子浓度大小关系为__________,用离子方程式表示出溶液显碱性的原因_______________。
(4)在容积均为VL的Ⅰ、Ⅱ、Ⅲ三个相同密闭容器中,分别放入ag的储氢合金(M)和bmol氢气发生如下反应:2M(s)+xH
2 (g)
2MH
x (s) ΔH<0,三个容器的反应温度分别为T
1 、T
2 、T
3 且恒定不变,在其他条件相同的情况下,实验测得反应均进行到1min时M的质量如图1所示,此时Ⅰ、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是___________,当三个容器反应都达到化学平衡时,H
2 转化率最大的反应温度是______。
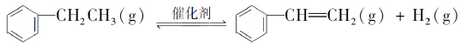
(5)储氢还可以借助有机物,如利用乙苯与苯乙烯之间的可逆反应来实现脱氢和加氢;
①在恒容密闭容器中,控制不同温度进行乙苯的脱氢实验。以乙苯起始浓度均为c mol/L测定乙苯的转化率,结果如图2所示。图中A为乙苯的平衡转化率与温度关系曲线,B曲线表示不同温度下反应经过相同时间且为达到化学平衡时乙苯的转化率。试说明随温度的升高,曲线B向曲线A逼近的原因__________。
②维持体系总压恒定,在温度T时,物质的量为n、体积为V的乙苯蒸气发生催化脱氢。已知乙苯的平衡转换率为a,则在该温度下反应的平衡常数K=__________(用a等符号表示)。
题号:3751967
题型:简答题
难易度:较难
日期:2017-06-05
来源:【全国百强校】福建省厦门外国语学校2017-2018学年高二6月月考化学试题
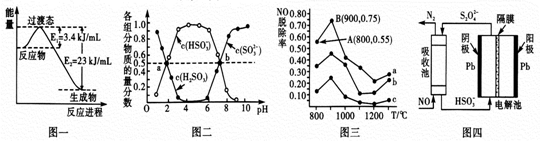
【题文】C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。
(1)目前工业上有一种方法是用CO,和H
2 在230℃,催化剂条件下转化生成甲醇蒸汽和水蒸气。
图一表示恒压容器中0.5molCO
2 和1.5molH
2 转化率达80%时的能量变化示意图。写出该反应的热化学方程式_____________。
(2) “亚硫酸盐法”吸收烟气中的SO
2 。室温条件下,将烟气通入(NH
4 )
2 SO
4 溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图二所示。
请写出a点时n(HSO
3 - ):n(H
2 SO
3 )=______,b点时溶液pH=7,则n(NH
4 + ):n(HSO
3 - )=___。
(3)催化氧化法去除NO,一定条件下,用NH
3 消除NO污染,其反应原理为4NH
3 +6NO
5N
2 + 6H
2 O。不同温度条件下,n(NH
3 ):n(NO)的物质的量之比分别为4:l、3:l、1:3时,得到NO脱除率曲线如图三所示:
① 请写出N
2 的电子式________。
② 曲线c对应NH
3 与NO的物质的量之比是______。
③ 曲线a中NO的起始浓度为6×10
-4 mg/m
3 ,从A点到B点经过0.8s,该时间段内NO的脱除速率为_____mg/(m
3 ·s)。
(4)间接电化学法可除NO。其原理如图四所示,写出电解池阴极的电极反应式(阴极室溶液呈酸性):_________________。
题号:3751968
题型:简答题
难易度:较难
日期:2017-06-05
来源:【全国百强校】福建省厦门外国语学校2017-2018学年高二6月月考化学试题
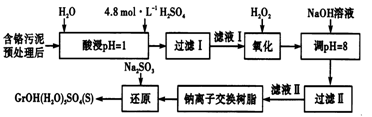
【题文】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下。
其中硫酸浸取液中的金属离子主要是Cr
3+ ,其次是Fe
3+ 、Al
3+ 、Ca
2+ 和Mg
2+ 。
(l)实验室用18.4mol/L的浓硫酸配制225mL4.8mol/L的H
2 SO
4 溶液,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需要__________________。
(2)酸浸时,为了提高浸取率除了增大酸的浓度外还可采取的措施有______(答出一点即可)。
(3)H
2 O
2 的作用是将滤液I中的Cr
3+ 转化为Cr
2 O
7 2- ,写出此反应的离子方程式______。
(4)常温下,部分阳离子以氮氧化物形式沉淀时,溶液的pH如下:
阳离子 Fe3+ Mg2+ Al3+ 开始沉淀时的pH 2.7 — — 沉淀完全时的pH 3.7 11.1 8
加入NaOH溶液使溶液呈碱性,Cr
2 O
7 2- 转化为CrO
4 2- 溶液的pH不能超过8,其理由_______。
(5)钠离子交换树脂的反应原理为M
n+ +nNaR→MR
n +nNa
+ ,利用钠离子交换树脂除去的滤液Ⅱ中的金属阳离子是____________。
(6)写出上述流程中用Na
2 SO
3 进行还原时发生反应的化学方程式_______,在实验室进行过滤操作时,为了加快过滤速率,可以采取的措施为_________(写一种方法即可).
 ,且x+y+z=1.充电时电池总反应为LiNixCoyMnzO2+6C(石墨)= Li1-aNixCoyMnzO2+LiaC6,其电池工作原理如图所示,两极之间有一个允许特定的离子X通过的隔膜。下列说法正确的是
,且x+y+z=1.充电时电池总反应为LiNixCoyMnzO2+6C(石墨)= Li1-aNixCoyMnzO2+LiaC6,其电池工作原理如图所示,两极之间有一个允许特定的离子X通过的隔膜。下列说法正确的是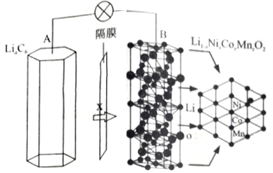
 I2+I-平衡
I2+I-平衡 2SOCl2,部分装置如图所示。
2SOCl2,部分装置如图所示。
 xNiOOH+MHx,试写出放电过程中负极
xNiOOH+MHx,试写出放电过程中负极 2MHx(s) ΔH<0,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到1min时M的质量如图1所示,此时Ⅰ、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是___________,当三个容器反应都达到化学平衡时,H2转化率最大的反应温度是______。
2MHx(s) ΔH<0,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到1min时M的质量如图1所示,此时Ⅰ、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是___________,当三个容器反应都达到化学平衡时,H2转化率最大的反应温度是______。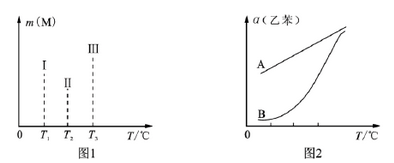
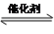 5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:l、3:l、1:3时,得到NO脱除率曲线如图三所示:
5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:l、3:l、1:3时,得到NO脱除率曲线如图三所示: