适用年级:{{getGradeNameByProperty('高三|月考试卷|福建|2016年')}} 试卷类型:{{getTestPaperTypeName('高三|月考试卷|福建|2016年')}} 使用省份:{{getAreaName('高三|月考试卷|福建|2016年')}}
试卷年份:{{getYear('高三|月考试卷|福建|2016年')}}上传日期:2016-06-22题数:12
提示:单击题文可显示答案与解析。
题号:1436991
题型:选择题
难易度:较易
日期:2016-06-22
来源:【百强校】2016届福建厦门外国语学校高三5月月考理综化学试卷(带解析)
【题文】在t ℃时,AgI在水中的沉淀溶解平衡曲线如图所示,又知t℃时AgBr的K
sp=5×10
-13。下列说法不正确的是( )
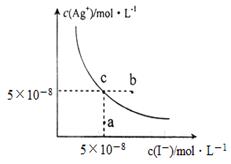
| A.在t℃时,AgI的Ksp=2.5×10-15 mol2.L-2 |
| B.图中b点有碘化银晶体析出 |
| C.向c点溶液中加入适量蒸馏水,可使溶液由c点到a点 |
D.在t℃时,反应AgBr(s)+I-(aq) AgI(s)+Br-(aq)的平衡常数K=200 AgI(s)+Br-(aq)的平衡常数K=200 |
题号:1436992
题型:选择题
难易度:较易
日期:2016-06-22
来源:【百强校】2016届福建厦门外国语学校高三5月月考理综化学试卷(带解析)
【题文】W、X、Y、Z均为短周期主族元素,原子序数依次增大。W的最外层电子数、电子层数和主族序数均相等。Y原子最外层电子数与W、X原子最外层电子数之和相等。X原子的最外层电子数是内层电子数的2倍还多1个。Z是所在周期中主族元素原子半径最大的元素。下列说法正确的是( )
| A.离子半径大小顺序为:Z>X>Y>W |
| B.W、X、Y三种元素都属于非金属元素,它们之间只能形成共价化合物 |
| C.X、Y、Z三种元素与W 元素形成的最简单化合物的沸点依次升高 |
| D.X、Y、Z三种元素形成的化合物的水溶液一定显中性 |
题号:1436993
题型:选择题
难易度:较易
日期:2016-06-22
来源:【百强校】2016届福建厦门外国语学校高三5月月考理综化学试卷(带解析)
【题文】下列实验操作与预期实验目的或所得实验结论不一致的是
选项
| 实验操作
| 实验目的或结论
|
A
| 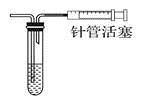 向里推注射器 向里推注射器
| 通过观察液面差判断该装置的气密性
|
B
| 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH) 2粉末,搅拌一段时间后过滤
| 除去MgCl2溶液中少量FeCl3
|
C
| 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生
| 说明常温下
Ksp(BaCO3)<Ksp(BaSO4)
|
D
| C2H5OH与浓硫酸170 ℃共热,制得的气体通入酸性KMnO4溶液
| 不能检验制得的气体是否为乙烯
|
题号:1436994
题型:选择题
难易度:一般
日期:2016-06-22
来源:【百强校】2016届福建厦门外国语学校高三5月月考理综化学试卷(带解析)
【题文】一种微生物燃料电池如图所示,下列关于该电池说法正确的是
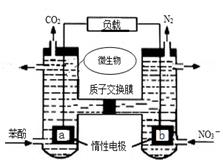
| A.a电极发生还原反应,做原电池的正极 |
| B.b电极反应式为:2NO3-+10e-+12H+=N2↑+6H2O |
| C.H+由右室通过质子交换膜进入左室 |
| D.标准状况下,电路中产生6moLCO2同时产生22.4L的N2 |
题号:1436995
题型:选择题
难易度:较易
日期:2016-06-22
来源:【百强校】2016届福建厦门外国语学校高三5月月考理综化学试卷(带解析)
【题文】某有机物的结构简式如图所示,下列有关该有机物的说法正确的是
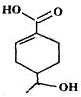
| A.分子中含有四种官能团 |
| B.1mol该有机物完全燃烧消耗O2的物质的量为10mol |
| C.能发生加成、取代、消去、水解等反应 |
| D.相同条件下,等量的该有机物分别与足量的Na和NaHCO3溶液反应产生气体的量相同 |
题号:1436996
题型:选择题
难易度:较易
日期:2016-06-22
来源:【百强校】2016届福建厦门外国语学校高三5月月考理综化学试卷(带解析)
【题文】设N
A为阿伏加德罗常数的值,下列叙述中正确的是
| A.NA个Fe(OH)3胶体粒子的质量为107g |
| B.标准状况下,1L液态水中含有的H+数目为10-7NA |
| C.14g分子式为CnH2n的链烃中含有的碳碳双键的数目为NA/n |
| D.1 mol冰醋酸和l mo1乙醇经酯化反应可生成H2O分子数为NA |
题号:1436997
题型:选择题
难易度:一般
日期:2016-06-22
来源:【百强校】2016届福建厦门外国语学校高三5月月考理综化学试卷(带解析)
【题文】晚唐诗人李商隐的《无题·相见时难别亦难》中写到“春蚕到死丝方尽,蜡炬成灰泪始干”,下列说法正确的是
| A.蚕丝属于纤维素 |
| B.蜡烛的主要成分是石蜡,属于混合物 |
| C.“泪”是指石蜡燃烧生成的水 |
| D.蚕丝和石蜡完全燃烧所得产物相同 |
题号:1436990
题型:实验题
难易度:较易
日期:2016-06-22
来源:【百强校】2016届福建厦门外国语学校高三5月月考理综化学试卷(带解析)
【题文】TiO
2和TiCl
4都是钛的重要化合物,某化学兴趣小组在实验室对两者的制备及性质进行探究。
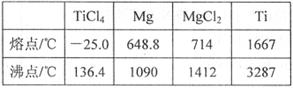
Ⅰ.制备TiCl
4实验室利用反应TiO
2 (s)+CCl
4(g)

TiCl
4(g)+CO
2(g),在无水无氧条件下制备TiCl
4,装置图和有关信息如下:
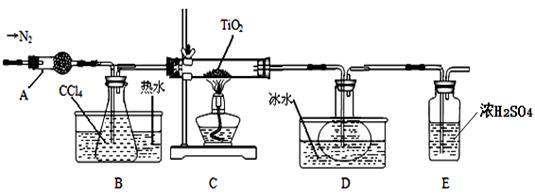
物质
| 熔点/℃
| 沸点/℃
| 其他
|
CCl4
| —23
| 76
| 与TiCl4互溶
|
TiCl4
| —25
| 136
| 遇潮湿空气产生白雾
|
请回答下列问题:
(1)仪器A的名称是
。
(2)实验开始前后的操作包括:①检查装置气密性,②组装仪器,③通N
2一段时间,④加装药品,⑤点燃
酒精灯⑥停止通N
2⑦停止加热。正确的操作顺序是__________________________。实验结束后欲分离D中的液态混合物,所采用操作的名称是
。
(3)装置E能否
(填“能”或“不能”)换成装置A,理由是
。
(4)TiCl
4是制取航天航空工业材料——钛合金的重要原料。某钛合金的元素还有Al和Si等,已知在常温下,钛是一种耐强酸强碱的金属,请设计实验检验其中的Si元素。
。
Ⅱ.制备TiO
2及测定TiO
2的质量分数:
在TiCl
4中加水、加热,水解得到沉淀TiO
2·xH
2O,经过滤、水洗,再烘干、焙烧除去水分得到粉体TiO
2。
(5)写出生成TiO
2·xH
2O的化学方程式
。
(6)检验沉淀是否洗涤干净的方法是___________________________________________。
(7) 一定条件下,将TiO
2溶解并还原为Ti
3+,用NH
4Fe(SO
4)
2标准溶液滴定Ti
3+至全部生成Ti
4+。滴定分析时,称取上述TiO
2试样0.2g,消耗0.1 mol·L
-1 NH
4Fe(SO
4)
2标准溶液20mL。
①配制NH
4Fe(SO
4)
2标准溶液时,加入一定量H
2SO
4的目的是:
。
②该滴定操作所用到的指示剂是
。
③则TiO
2质量分数为
。
题号:1436988
题型:填空题
难易度:较易
日期:2016-06-22
来源:【百强校】2016届福建厦门外国语学校高三5月月考理综化学试卷(带解析)
【题文】[化学——选修3:物质结构与性质]太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质。
(1)基态硅原子的价电子排布图:
。
(2)硒和硫同为VIA族元素,与其相邻的元素有砷和溴,则三种元素的第二电离能由小到大的顺序为
。(用I
2X表示)
(3)气态SeO
3分子的杂化类型为
,与SeO
3互为等电子体的一种阴离子为
(填化学式)。
(4)胆矾CuSO
4·5H
2O可写成[Cu(H
2O)
4]SO
4·H
2O,其结构示意图如下:
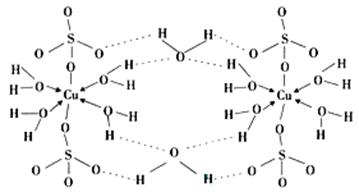
胆矾中含有的粒子间作用力是
(填序号)。
| A.离子键 | B.极性键 | C.金属键 | D.配位键 E.氢键 F.非极性键 |
(5)在硫酸铜溶液中加入过量KCN,生成配合物K
2[Cu(CN)
4],该配合物属于
晶体,已知CN
-与N
2为等电子体,指出1molCN
-中
键的数目为
。
(6)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中铜原子(Cu)与金原子(Au)个数比为
;若该晶体的晶胞棱长为a nm,则该合金密度为
g/cm
3。(列出计算式,不要求计算结果,阿伏加德罗常数的值为N
A)
题号:1436989
题型:填空题
难易度:一般
日期:2016-06-22
来源:【百强校】2016届福建厦门外国语学校高三5月月考理综化学试卷(带解析)
【题文】研究NO
x、CO等大气污染气体的处理及利用的方法具有重要意义,可实现绿色环保、节能减排、废物利用等目的。
(1) 利用甲烷催化还原NO
x:
CH
4(g)+4NO
2(g)═4NO(g)+CO
2(g)+2H
2O(g)△H1=﹣574kJ•mol
﹣1CH
4(g)+4NO(g)═2N
2(g)+CO
2(g)+2H
2O(g)△H
2=﹣1160kJ•mol
﹣1甲烷直接将NO
2还原为N
2的热化学方程式为
。
(2)已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H
2O(g)

H
2(g)+CO
2(g),500℃时的平衡常数为9,若在该温度下进行,设起始时CO和H
2O的起始浓度均为0.020 mol·L
-1,则CO的平衡转化率为:
。
(3) 用活化后的V
2O
5作催化剂,氨气将NO还原成N
2的一种反应历程如图1所示。
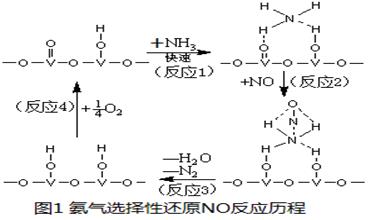
①写出总反应化学方程式
。
②测得该反应的平衡常数与温度的关系为:lgK=5.08+217.5/T,该反应是
反应(填“吸热”或“放热”)。
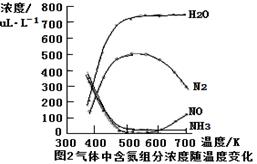
③该反应的含氮气体组分随温度变化如图2所示,当温度达到700K时,发生副反应的化学方程式
。
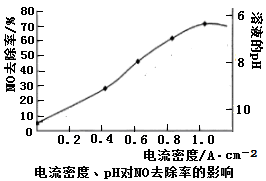
(4)下图是用食盐水做电解液电解烟气脱氮的一种原理图,NO被阳极产生的氧化性物质氧化为NO
3—,尾气经氢氧化钠溶液吸收后排入空气。如下图,电流密度和溶液pH对烟气脱硝的影响。
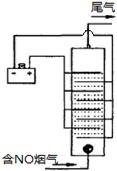
①NO被阳极产生的氧化性物质氧化为NO
3-反应的离子方程式
。
②溶液的pH对NO去除率影响的原因是
。
③若极板面积10cm
2,实验烟气含NO 1.5%,流速为0.070L·s
-1(气体体积已折算成标准状态,且烟气中无其他气体被氧化),法拉第常数为96500 C·mol
-1,测得电流密度为1.0 A·cm
-2。列式计算实验中NO除去率
。
题号:4301848
题型:填空题
难易度:较易
日期:2016-06-22
来源:【百强校】2016届福建厦门外国语学校高三5月月考理综化学试卷(带解析)
【题文】砷(As)是第四周期第VA族元素,它在自然界中的含量不高,但人类认识它、研究它的历史却很长。
(1)砷的氢化物的化学式为________,其稳定性比磷的氢化物____(填“强或弱”)。已知H
3AsO
3是两性偏酸性的化合物,它与硫酸反应的化学方程式为
。NaHAsO
3溶液呈碱性,该溶液中c(H
2AsO
3-)
C(AsO
33-)(填“>”、“<”或“=”)。
(2)砷在自然界中主要以硫化物形式(如雄黄As
4S
4、雌黄As
2S
3等)存在。
①工业上以雄黄为原料制备砷的过程是:先在空气中煅烧使其转化为砒霜(As
2O
3),然后用焦炭还原。写出焦炭还原时发生反应的化学方程式:
。砒霜有剧毒,卫生防疫分析中鉴定的方法是:先将试样与锌、硫酸混合在一起反应,将生成的气体导入到热玻璃管中热解,若玻璃管中产生亮黑色的“砷镜”,则说明试样中含有As
2O
3。写出上述鉴定过程中有关反应的化学方式:
。
②“砷镜”可被漂白精氧化为H
3AsO
4,反应中还原剂与氧化剂物质的量之比为
。
(3)已知砷酸(H
3AsO
4)是三元酸,有较强的氧化性。
①常温下砷酸的K
1=6×10
-3、K
2=1×10
-7,则NaH
2AsO
4溶液的pH为____7。(填“>”、“<”、“=”),判断依据为___________________________________________________________________。
②某原电池装置如图所示,电池总反应为AsO
43-+2I
-+H
2O

AsO
33-+I
2+2OH
-。
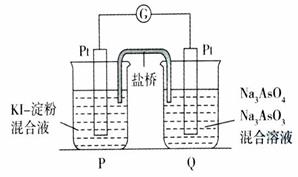
当P池中溶液由无色变成蓝色时,正极上的电极反应式为
。当电流计指针归中后向Q池中加入一定量的NaOH,则电池负极所在的烧杯为
(填“P”或“Q”)。
题号:1436987
题型:推断题
难易度:困难
日期:2016-06-22
来源:【百强校】2016届福建厦门外国语学校高三5月月考理综化学试卷(带解析)
【题文】[化学——选修5:有机化学基础]芳香族化合物X是一种天然食用香料,可以从某些植物中提取。X能发生下列转化:
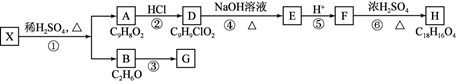
已知:①A的核磁共振氢谱有6个峰;②H为酯类结构,结构中除苯环外还含有一个六元环。③G的产量是衡量一个国家石油化工发展水平的标志
请回答下列问题:
(1)反应①~⑥中,属于加成反应的是
(填序号)。③的反应条件是
。
(2)反应①的化学方程式为
。检验A中非含氧官能团所用的试剂为
。
(3)D的结构简式为
。
(4)F的同分异构体中,遇FeCl
3溶液发生显色反应,且能与碳酸氢钠溶液反应,其苯环上一氯代物只有一种,符合条件的同分异构体数目为
种,写出所有的同分异构体结构简式:
。

 AgI(s)+Br-(aq)的平衡常数K=200
AgI(s)+Br-(aq)的平衡常数K=200 向里推注射器
向里推注射器


 TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,装置图和有关信息如下:
TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,装置图和有关信息如下:

 键的数目为 。
键的数目为 。 H2(g)+CO2(g),500℃时的平衡常数为9,若在该温度下进行,设起始时CO和H2O的起始浓度均为0.020 mol·L-1,则CO的平衡转化率为: 。
H2(g)+CO2(g),500℃时的平衡常数为9,若在该温度下进行,设起始时CO和H2O的起始浓度均为0.020 mol·L-1,则CO的平衡转化率为: 。



 AsO33-+I2+2OH-。
AsO33-+I2+2OH-。
