适用年级:{{getGradeNameByProperty('高三|月考试卷|福建|2015年')}} 试卷类型:{{getTestPaperTypeName('高三|月考试卷|福建|2015年')}} 使用省份:{{getAreaName('高三|月考试卷|福建|2015年')}}
试卷年份:{{getYear('高三|月考试卷|福建|2015年')}}上传日期:2015-01-05题数:23
提示:单击题文可显示答案与解析。
题号:3222570
题型:选择题
难易度:一般
日期:2015-01-05
来源:2015届福建省莆田八中高三第一次月考化学试卷(带解析)
【题文】常温下,往H
2O
2溶液中滴加少量FeSO
4溶液,可发生如下两个反应:2Fe
2++H
2O
2+2H
+=2Fe
3++2H
2O,2Fe
3++H
2O
2=2Fe
2++O
2↑+2H
+ 下列说法正确的是
| A.H2O2生产过程要严格避免混入Fe2+ |
| B.在H2O2分解过程中,溶液的pH逐渐下降 |
| C.在H2O2分解过程中, Fe2+和Fe3+的总量发生变化 |
| D.H2O2的氧化性比Fe3+强,其还原性比Fe2+弱 |
题号:3222571
题型:选择题
难易度:较易
日期:2015-01-05
来源:2015届福建省莆田八中高三第一次月考化学试卷(带解析)
【题文】
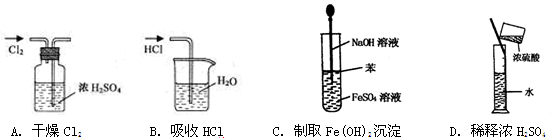
题号:3222572
题型:选择题
难易度:一般
日期:2015-01-05
来源:2015届福建省莆田八中高三第一次月考化学试卷(带解析)
【题文】如图所示,在蒸发皿中放一小块钠,加热至熔化时,用玻璃棒蘸取少量无水CuSO
4与熔化的钠接触,瞬间产生耀眼的火花,同时有红色物质生成。据此判断下列说法中不正确的是
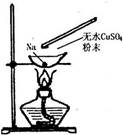
| A.上述反应是置换反应 |
| B.上述反应是放热反应 |
| C.上述反应中CuSO4表现了还原性 |
| D.加热且无水条件下,Na可以与CuSO4反应并生成Cu |
题号:3222573
题型:选择题
难易度:一般
日期:2015-01-05
来源:2015届福建省莆田八中高三第一次月考化学试卷(带解析)
【题文】向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是
| 操作
| 现象
| 结论
|
A
| 滴加BaCl2溶液
| 生成白色沉淀
| 原溶液中有SO42-
|
B
| 滴加氯水和CCl4,振荡、静置
| 下层溶液显紫色
| 原溶液中有I-
|
C
| 用洁净铂丝蘸取溶液进行焰色反应
| 火焰呈黄色
| 原溶液中有Na+,无K+
|
D
| 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口
| 试纸不变蓝
| 原溶液中无NH4+
|
题号:3222574
题型:选择题
难易度:一般
日期:2015-01-05
来源:2015届福建省莆田八中高三第一次月考化学试卷(带解析)
【题文】草酸溶液能使酸性KMnO
4溶液褪色,其离子方程式为:MnO
4-+H
2C
2O
4+H
+→CO
2↑+Mn
2++
__(未配平)。关于此反应的叙述正确的是
| A.该反应的还原产物是CO2 | B.该反应右框内的产物是OH- |
| C.配平该反应后,H+计量数是6 | D.1molMnO4-在反应中失去5mol电子 |
题号:3222575
题型:选择题
难易度:一般
日期:2015-01-05
来源:2015届福建省莆田八中高三第一次月考化学试卷(带解析)
【题文】将过量CO
2通入NaOH和Ca(OH)
2的混合稀溶液中,生成沉淀的质量(m)和通入CO
2(V)关系图,正确的是
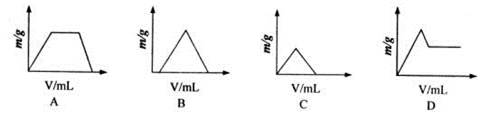
题号:3222576
题型:选择题
难易度:较难
日期:2015-01-05
来源:2015届福建省莆田八中高三第一次月考化学试卷(带解析)
【题文】海洋中有丰富的食品、矿产资源、药物和水产资源等(如图所示),下列有关说法不正确的是
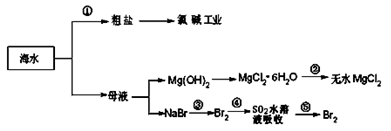
| A.从能量转换角度来看,框图中的氯碱工业是一个将电能转化为化学能的过程 |
| B.过程②中结晶出的MgCl2·6H2O要在HCl氛围中加热脱水制得无水MgCl2 |
| C.在过程③⑤中溴元素均被氧化 |
D.过程①中除去粗盐中的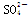 、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
题号:3222577
题型:选择题
难易度:较难
日期:2015-01-05
来源:2015届福建省莆田八中高三第一次月考化学试卷(带解析)
【题文】在标准状况下,0.0672L H
2S气体通入含有1.0×10
-3mol X
2O
72-离子的酸性溶液中,两者恰好完全反应,而且H
2S全部被氧化成硫单质,则X元素在还原产物中的化合价为


题号:3222578
题型:选择题
难易度:较易
日期:2015-01-05
来源:2015届福建省莆田八中高三第一次月考化学试卷(带解析)
【题文】在配制一定物质的量浓度的NaOH溶液时,下列哪个原因会造成所配溶液浓度偏高
| A.所用NaOH已经潮解 | B.向容量瓶中加水未到刻度线 |
| C.有少量NaOH溶液残留在烧杯里 | D.定容时仰视刻度线 |
题号:3222579
题型:选择题
难易度:一般
日期:2015-01-05
来源:2015届福建省莆田八中高三第一次月考化学试卷(带解析)
【题文】在含FeCl
3、FeCl
2、AlCl
3、NaCl的溶液中,加入足量的Na
2O固体,在空气中充分搅拌反应后再加入过量的稀盐酸,溶液中离子数目变化最小的是
题号:3222580
题型:选择题
难易度:较易
日期:2015-01-05
来源:2015届福建省莆田八中高三第一次月考化学试卷(带解析)
【题文】分别往含有下列离子的溶液中通入氯气,离子不会减少的是
题号:3222581
题型:选择题
难易度:较易
日期:2015-01-05
来源:2015届福建省莆田八中高三第一次月考化学试卷(带解析)
【题文】下列各组物质相互作用,生成物不随反应条件或反应物的用量变化而变化的是
| A.Na和O2 | B.NaOH和CO2 | C.NaHCO3和NaOH | D.Na2CO3和HCl |
题号:3222582
题型:选择题
难易度:较易
日期:2015-01-05
来源:2015届福建省莆田八中高三第一次月考化学试卷(带解析)
【题文】ClO
2是一种杀菌消毒效率高、二次污染小的水处理剂。实验室中可通过以下反应制得ClO
2:2KClO
3+H
2C
2O
4+H
2SO
4=2ClO
2↑+K
2SO
4+2CO
2↑+2H
2O,下列说法不正确的是
| A.CO2是氧化产物 |
| B.H2C2O4在反应中被氧化 |
| C.1mol KClO3参加反应,转移的电子为1mol |
| D.H2C2O4的氧化性强于ClO2的氧化性 |
题号:3222583
题型:选择题
难易度:较易
日期:2015-01-05
来源:2015届福建省莆田八中高三第一次月考化学试卷(带解析)
【题文】“绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如下装置与操作以替代相关的课本实验。先给钠预热,当钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。
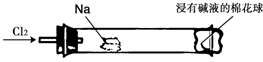
以下叙述错误的是
| A.反应生成的大量白烟是氯化钠晶体 |
| B.玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免污染空气 |
| C.钠着火燃烧产生苍白色火焰 |
| D.棉球外沿滴一滴淀粉碘化钾溶液,可据其颜色变化判断氯气是否被碱液完全吸收 |
题号:3222584
题型:选择题
难易度:较易
日期:2015-01-05
来源:2015届福建省莆田八中高三第一次月考化学试卷(带解析)
【题文】关于下列说法:①Fe(OH)
3胶体和CuSO
4溶液都是混合物;②蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质;③冰醋酸、纯碱、小苏打分别属于酸、碱、盐;④、天然气、水煤气和太阳能分别属于化石能源、不可再生能源和新能源;⑤Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到。其中正确的是
题号:3222585
题型:选择题
难易度:一般
日期:2015-01-05
来源:2015届福建省莆田八中高三第一次月考化学试卷(带解析)
【题文】设N
A为阿伏加德罗常数的数值,下列说法正确的是
| A.常温下,23g NO2含有NA个氧原子 |
| B.1 L 0.1 mol•L-1的氨水含有0.1NA个OH― |
| C.标准状况下,22.4 L CCl4含有NA 个CCl4分子 |
| D.1 mol Fe2+与足量的H2O2溶液反应,转移2NA个电子 |
题号:3222586
题型:选择题
难易度:一般
日期:2015-01-05
来源:2015届福建省莆田八中高三第一次月考化学试卷(带解析)
【题文】化学与生活是紧密相联的,下列说法正确的是
| A.地震灾区用漂白粉消毒,是利用漂白粉溶液的碱性 |
| B.鱼、肉、鸡蛋等富含蛋白质的食品被称为碱性食品,长期缺乏可使尿液偏酸性 |
| C.小苏打的主要成分是碳酸钠 |
| D.实验室储存的镁条着火时,不可以用泡沫灭火器灭火 |
题号:4309343
题型:选择题
难易度:一般
日期:2015-01-05
来源:2015届福建省莆田八中高三第一次月考化学试卷(带解析)
【题文】某校学生用化学知识解决生活中的问题,下列家庭小实验不合理的是
| A.用食醋除去暖水瓶中的薄层水垢 |
| B.用米汤检验含碘盐中的碘酸钾(KIO3) |
| C.用Na2CO3溶液洗涤餐具上的油污 |
| D.用灼烧并闻气味的方法区别纯棉织物和纯毛织物 |
题号:4309344
题型:选择题
难易度:较易
日期:2015-01-05
来源:2015届福建省莆田八中高三第一次月考化学试卷(带解析)
【题文】氯气是一种重要的工业原料。工业上利用反应3Cl
2+2NH
3=N
2+6HCl检查氯气管道是否漏气。下列说法错误的是
| A.若管道漏气遇氨就会产生白烟 |
| B.该反应利用了Cl2的强氧化性 |
| C.该反应属于复分解反应 |
| D.生成1 mol N2有6 mol电子转移 |
题号:3222567
题型:实验题
难易度:较难
日期:2015-01-05
来源:2015届福建省莆田八中高三第一次月考化学试卷(带解析)
【题文】(16分)某中学研究性学习小组为探究碳酸钠和碳酸氢钠两种物质的性质、制法和用途,进行了如下实验:
实验一、如图Ⅰ~Ⅳ所示。
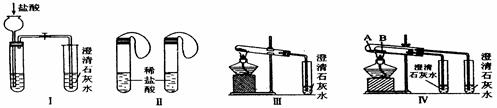
(1)若用实验Ⅳ来验证碳酸钠和碳酸氢钠的热稳定性,则试管B中装入的固体最好是
,能说明碳酸钠比碳酸氢钠稳定的实验现象是
。
(2)若用实验来鉴别碳酸钠和碳酸氢钠两种固体,能达到实验目的的是(填装置序号)
。其中能够说明泡沫灭火器中选择碳酸氢钠与酸反应制CO
2而不选择碳酸钠的实验是
。
(3)若测定Na
2CO
3固体中混有的少量NaHCO
3的质量分数,采用实验Ⅲ能否达到实验目的?若能,请说明其计算所需的数据
;若不能,请简要说明理由
。
实验二、将碳酸氢钠溶液与澄清石灰水混合并充分反应。
(4)当石灰水过量时,反应的离子方程式为
。
(5)当碳酸氢钠与氢氧化钙物质的量之比为2:1时,所得溶液中溶质的化学式为
。
实验三、(6)检验“侯氏制碱法”制得的纯碱中是否混有食盐所需的试剂是
;
题号:3222568
题型:实验题
难易度:较难
日期:2015-01-05
来源:2015届福建省莆田八中高三第一次月考化学试卷(带解析)
【题文】(14分)(I)下列有关实验的叙述中,合理的是
(填序号)
A.用CCl4萃取碘水中的碘,分液时,有机层从分液漏斗下口放出
|
B.不宜用瓷坩埚灼烧氢氧化钠或碳酸钠
|
C.将l0 g ZnSO4·7H2O溶解在90 g水中配制10%的ZnSO4溶液
|
D.向某溶液中加氯化钡溶液,产生不溶于稀硝酸的白色沉淀,则该溶液中一定含有SO42—
|
E.配制一定物质的量浓度的溶液,定容时俯视容量瓶的刻度线,会使所配溶液浓度偏高
(II)二氯化硫(SCl
2)熔点—78℃,沸点59℃。密度1.638g/mL。遇水易分解。二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl
2)。以下是由氯气与硫反应合成二氯化硫的实验装置。
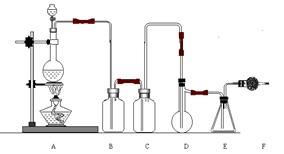
试回答下列:
(1)装置A中反应的离子方程式为:
。
(2)装置B盛放的药品是
;C中是
。
(3)实验开始前先在D中放入一定量的硫粉,加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁形成一薄层表面,这样做的目的是
。
(4)实验时,D装置需加热至50—59
oC,最好采用何种方式
加热。
(5)F装置中干燥管内所盛物质是
,作用是:
。
(6)由二氯化硫与SO
3作用生成亚硫酰氯的化学方程式为:
。
题号:3222569
题型:实验题
难易度:一般
日期:2015-01-05
来源:2015届福建省莆田八中高三第一次月考化学试卷(带解析)
【题文】
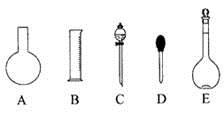
(1)如图所示的仪器中配制溶液肯定不需要的是
(填序号),配制上述溶液还需用到的玻璃仪器是
(填仪器名称)。
(2)下列操作中,容量瓶所不具备的功能有
(填序号。)
A.配制一定体积准确浓度的标准溶液
|
B.量取一定体积的液体
|
C.测量容量瓶规格以下的任意体积的液体
|
D.准确稀释某一浓度的溶液。
|
E.贮存溶液
F.用来加热溶解固体溶质
(3)根据计算得知,所需质量分数为98%、密度为1.84 g/cm
3的浓硫酸的体为
mL(保留一位小数)。如果实验室有10mL、15mL、20mL、50mL量筒,应选用
mL量筒最好。
(4)根据计算用托盘天平称取NaOH的质量为
g。在实验中其他操作均正确,若定容时俯视视刻度线,则所得溶液浓度
0.8 mol/L(填“大于”、“等于”或“小于”,下同)。若定容时,有少许蒸馏水洒落在容量瓶外,则所得溶液浓度
0.8 mol/L。
题号:3222566
题型:填空题
难易度:较难
日期:2015-01-05
来源:2015届福建省莆田八中高三第一次月考化学试卷(带解析)
【题文】(18分)高铁酸钾(K
2FeO
4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
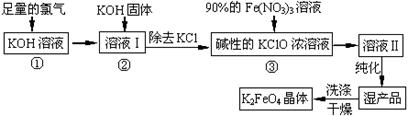
(1)反应①应在温度较低的情况下进行。因在温度较高时KOH 与Cl
2反应生成的是KClO
3。写出在温度较高时KOH与Cl
2反应的化学方程式
,当反应中转移5 mol电子时,消耗的氯气是
mol。
(2)在反应液I中加入KOH固体的目的是
(填编号)。
| A.与反应液I中过量的Cl2继续反应,生成更多的KClO |
| B.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |
| C.为下一步反应提供碱性的环境 |
| D.使KClO3转化为 KClO |
(3)从溶液II中分离出K
2FeO
4后,还会有副产品KNO
3、KCl,则反应③中发生的离子反应方程式为
。
(4)如何判断K
2FeO
4晶体已经洗涤干净
。
(5)高铁酸钾(K
2FeO
4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,其离子反应是:
FeO
42¯ +
H
2O =
Fe(OH)
3(胶体) +
O
2↑ +
完成并配平上述反应的离子方程式。




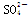 、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸





