适用年级:{{getGradeNameByProperty('高三|月考试卷|福建|2015年')}} 试卷类型:{{getTestPaperTypeName('高三|月考试卷|福建|2015年')}} 使用省份:{{getAreaName('高三|月考试卷|福建|2015年')}}
试卷年份:{{getYear('高三|月考试卷|福建|2015年')}}上传日期:2015-06-30题数:11
提示:单击题文可显示答案与解析。
题号:3204751
题型:选择题
难易度:较难
日期:2015-06-30
来源:2015届福建省南侨中学等五校高三“最后一卷”理综化学试卷(带解析)
【题文】工业上消除氮氧化物的污染可用如下反应:
CH
4(g)+2NO
2(g)

N
2(g)+CO
2(g)+2H
2O(g) △H=a kJ·mol
-1在温度T
1和T
2时,分别将0.50mol CH
4和1.2mol NO
2充入体积为1L的恒容密闭容器中,测得n(N
2)随时间变化的数据如下表:
温度
| n/mol
| 时间/min
|
0
| 10
| 20
| 40
| 50
|
T1
| n( N2)
| 0
| 0.20
| 0.35
| 0.40
| 0.40
|
T2
| n( N2)
| 0
| 0.25
| ……
| 0.30
| 0.30
|
下列说法不正确的是
A.10min内,T
1时的v(N
2)比T
2时的小
B.T
1<T
2C.a<0
D.T
2时,若向平衡后的容器中再充入1.2molCH
4,重新达到平衡时n(N
2)=0.40mol
题号:3204752
题型:选择题
难易度:较难
日期:2015-06-30
来源:2015届福建省南侨中学等五校高三“最后一卷”理综化学试卷(带解析)
【题文】已知甲、乙、丙、丁是中学化学常见的物质,一定条件下可发生如下转化:下列相关离子方程式或化学方程式错误的是
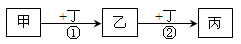
A.①可能为CH4+Cl2 CH3Cl+HCl CH3Cl+HCl |
| B.①可能为Fe+2Fe3+=3Fe2+ |
| C.②可能为2NO+O2=2NO2 |
| D.②可能为CO32-+H2O+CO2=2HCO3- |
题号:3204753
题型:选择题
难易度:较难
日期:2015-06-30
来源:2015届福建省南侨中学等五校高三“最后一卷”理综化学试卷(带解析)
【题文】设N
A为阿伏加德罗常数的值,下列叙述正确的是
| A.100mL 3.0mol/L的盐酸与5.6g铁屑完全反应转移的电子数为0.3NA |
| B.含2mol H2SO4的浓硫酸与足量金属铜完全反应,产生SO2的数目为NA |
| C.1L 0.1mol/L Na2CO3溶液中,阴阳离子总数为0.3NA |
| D.16.0g的过氧(根)离子中含有的电子数为9NA |
题号:3204754
题型:选择题
难易度:一般
日期:2015-06-30
来源:2015届福建省南侨中学等五校高三“最后一卷”理综化学试卷(带解析)
【题文】
| A.蒸发皿和烧杯均可用于加热 |
| B.为减少仪器使用而带来的误差,中和热测定实验中可用温度计兼做搅拌棒 |
| C.配置1L0.1mol·L-1NaCl溶液的实验中,用托盘天平称取5.85gNaCl |
| D.测定溶液中草酸含量时,用碱式滴定管盛装KMnO4标准液进行滴定操作 |
题号:3204755
题型:选择题
难易度:一般
日期:2015-06-30
来源:2015届福建省南侨中学等五校高三“最后一卷”理综化学试卷(带解析)
【题文】下列关于有机物的说法不正确的是
| A.甲烷和乙烯都可以与氯气反应,反应类型不同 |
| B.淀粉、油脂、蛋白质都可以水解 |
| C.乙烯和氯乙烯都可以通过聚合反应得到高分子材料 |
| D.乙醇和乙酸都存在碳氧双键,二者可以发生酯化反应 |
题号:4306390
题型:选择题
难易度:较难
日期:2015-07-01
来源:2015届福建省南侨中学等五校高三“最后一卷”理综化学试卷(带解析)
【题文】有人设计出利用CH
4和O
2的反应,用铂电极在KOH溶液中构成燃料电池。电池的总反应类似于CH
4在O
2中燃烧,则下列说法正确的是
| A.每消耗1molCH4可以向外电路转移4mol电子 |
| B.负极上CH4失去电子,电极反应式为CH4+10OH—=CO32—+7H2O+8e— |
| C.负极上是O2获得电子,电极反应式为:O2+2H2O+4e—=4OH— |
| D.电池放电后,溶液pH不断升高 |
题号:3204747
题型:填空题
难易度:困难
日期:2015-06-30
来源:2015届福建省南侨中学等五校高三“最后一卷”理综化学试卷(带解析)
【题文】(【化学—物质结构与性质】(13分)1)钠镁铝三种元素中第一电离能最大的是
。
(2)某正二价阳离子核外电子排布式为[Ar]3d
54s
0,该金属的元素符号为
。
(3)Mn和Fe的部分电离能数据如表:
元 素
| Mn
| Fe
|
电离能/kJ·mol-1
| I1
| 717
| 759
|
I2
| 1509
| 1561
|
I3
| 3248
| 2957
|
根据表数据,气态Mn
2+再失去一个电子比气态Fe
2+再失去一个电子难,其原因是
。
(4)①氨基乙酸铜的分子结构如图,碳原子的杂化方式为________。
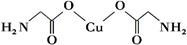
②金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)
4,呈四面体构型。423K时,Ni(CO)
4分解为Ni和CO,从而制得高纯度的Ni粉。试推测:四羰基镍的晶体类型是
(5)乙醇和二甲醚是同分异构体,但它们性质存在差异:
| 分子式
| 结构简式
| 熔点
| 沸点
| 水溶性
|
乙醇
| C2H6O
| C2H5OH
| -114.3℃
| 78.4 °C
| 互溶
|
二甲醚
| C2H6O
| CH3OCH3
| -138.5℃
| -24.9℃
| 微溶
|
乙醇和二甲醚沸点及水溶性差异的主要原因是
。
(6)金属铜溶于在浓氨水与双氧水的混合溶液,生成深蓝色溶液。该深蓝色的浓溶液中加入乙醇可见到深蓝色晶体([Cu(NH
3)
4]SO
4)析出,请画出呈深蓝色溶液的离子的结构简式
(标出配位键);深蓝色晶体中不存在的微粒间作用力有
。
A.范德华力
B.离子键
C.共价键
D.金属键
E.配位键
题号:3204748
题型:填空题
难易度:困难
日期:2015-06-30
来源:2015届福建省南侨中学等五校高三“最后一卷”理综化学试卷(带解析)
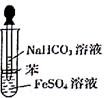
【题文】(15分)某校化学兴趣小组为探究FeSO
4和NaHCO
3的反应,按右图所示操作将NaHCO
3溶液滴加到FeSO
4溶液中(FeSO
4和NaHCO
3溶液均用经煮沸后冷却的蒸馏水配制,并在FeSO
4溶液中加入少量铁粉)。观察到试管中立即出现白色沉淀,同时有大量无色气体生成。
(1)实验室欲配制10%的NaHCO
3溶液,所需仪器有:烧杯、玻璃棒、药匙、
、
(写出另外两种)。
(2)产生的气体是
(填分子式)。
【查阅资料】FeCO
3为白色固体,不溶于水,在干燥空气中稳定,潮湿环境中需较长时间才能被氧化为Fe(OH)
3。
(3)关于白色沉淀的成分,小组同学提出如下假设,请补充完成假设3:
假设l:白色沉淀是Fe(OH)
2;
假设2:白色沉淀是FeCO
3;
假设3:白色沉淀是
。
(4)若假设2成立,写出生成FeCO
3的离子方程式:
。
经煮沸后冷却的蒸馏水配制FeSO
4溶液的目的是
某同学认为白色沉淀不可能为Fe(OH)
2,你是否同意其观点?
。(填“同意”或“不同意”)。
(5)请设计一个实验方案,验证假设2是否成立。
。
题号:3204749
题型:填空题
难易度:困难
日期:2015-06-30
来源:2015届福建省南侨中学等五校高三“最后一卷”理综化学试卷(带解析)
【题文】(15分)连二亚硫酸钠(Na
2S
2O
4)俗称保险粉,有极强的还原性。受热、遇水都会发生分解反应放出大量的热,甚至引起燃烧。不溶于乙醇,可溶于氢氧化钠水溶液并稳定存在。
(1)保险粉应如何保存?______________________________(填一注意事项)。
(2)锌粉法是制备Na
2S
2O
4的一种常见方法,其原理如图所示:
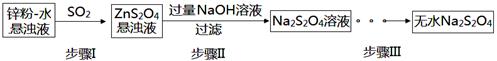
①步骤I中SO
2表现了____________(填“氧化性”、“还原性”或“酸性”);若用Na
2SO
3固体和某酸反应制备SO
2气体,你认为下列最适宜选用的酸是____________
| A.浓盐酸 | B.质量分数为70%的H2SO4 |
| C.稀硝酸 | D.质量分数为10%的稀硫酸 |
②常温下,若ZnS
2O
4悬浊液中c(Zn
2+)=0.1mol·L
-1,则应加氢氧化钠溶液调至pH≥_________,才能使Zn(OH)
2沉淀完全(已知离子浓度≤1.0×10
-5mol·L
-1,即沉淀完全;K
sp[Zn(OH)
2]=1.0×10
-17)
③步骤Ⅲ过程较为复杂,其中涉及过滤,洗涤,干燥等过程,请写出洗涤过程:_______________.
(3)甲酸钠法是制备Na
2S
2O
4的一种新方法,其原理为将甲酸钠(HCOONa)、碳酸钠溶于乙醇中,再通入足量的SO
2气体,析出Na
2S
2O
4固体。完成反应的化学方程式:
____HCOONa+____SO
2+___Na
2CO
3===____Na
2S
2O
4↓+___H
2O+_________
(4)保险粉在空气中容易吸收氧气而发生氧化。其方程式为:
①2Na
2S
2O
4+O
2+H
2O=4NaHSO
3或②2Na
2S
2O
4+O
2+H
2O=4NaHSO
3+NaHSO
4请设计实验证明氧化时发生的是②的反应。___________________
_________.
题号:3204750
题型:填空题
难易度:较难
日期:2015-06-30
来源:2015届福建省南侨中学等五校高三“最后一卷”理综化学试卷(带解析)
【题文】(15分)X是短周期中原子半径最小的元素,X、Y组成的气体甲能使湿润的红色石蕊试纸变蓝;
(1)Y的原子结构示意图是_______________.
(2)甲的水溶液与硫酸铝溶液反应离子方程式
.
(3)甲与氯化氢反应生成乙.乙所含化学键类型有
.在0.1mol•L
﹣1乙溶液中,所含离子浓度由大到小的顺序是
.
(4)工业上,可通过如下转化制得尿素晶体:
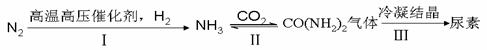
①Ⅰ中恒温恒容条件下,能同时提高化学反应速率和NH
3产率的是
。
②反应Ⅱ:2NH
3(g)+ CO
2(g)
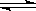
CO(NH
2)
2(g)+ H
2O(g) △H
1 =" -536.1" kJ·mol
-1(i)此反应的平衡常数表达式K=
。升高温度,K值
(填增大、减小或不变)。
(ii)尿素可用于处理汽车尾气。CO(NH
2)
2(g)与尾气中NO反应生成CO
2、N
2、H
2O(g)排出。
已知:4NH
3(g)+ 6NO(g)= 5N
2(g)+ 6H
2O(g) △H
2 =" -1806.4" kJ·mol
-1写出CO(NH
2)
2(g)与NO反应的热化学方程式
。
题号:3204746
题型:推断题
难易度:较难
日期:2015-06-30
来源:2015届福建省南侨中学等五校高三“最后一卷”理综化学试卷(带解析)
【题文】(13分)【[化学—有机化学基础】没食子酸丙酯简称PG,结构简式为
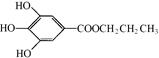
,是白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂。
(1)PG的分子式为
,请写出PG分子中所含官能团的名称
,1molPG与足量氢氧化钠溶液完全反应时,消耗的氢氧化钠的物质的量是
。
PG可发生如下转化:
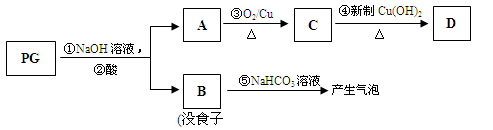
(2)A的结构简式为
,1mol没食子酸最多可与
mol H
2加成。
(3)上图的有关变化中,属于氧化反应的有(填序号)
。
(4)从分子结构或性质上看,PG具有抗氧化作用的主要原因是(填序号)
。
a.含有苯环 b.含有羧基 c.含有酚羟基 d.微溶于食用油
(5)反应④的化学方程式为:
。
(6)B有多种同分异构体,写出其中符合下列要求的同分异构体的结构简式:
。
i.含有苯环,且苯环上的一溴代物只有一种;
ii.既能发生银镜反应,又能发生水解反应。
 N2(g)+CO2(g)+2H2O(g) △H=a kJ·mol-1
N2(g)+CO2(g)+2H2O(g) △H=a kJ·mol-1
 CH3Cl+HCl
CH3Cl+HCl


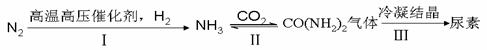
 CO(NH2)2(g)+ H2O(g) △H1 =" -536.1" kJ·mol-1
CO(NH2)2(g)+ H2O(g) △H1 =" -536.1" kJ·mol-1 ,是白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂。
,是白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂。