适用年级:{{getGradeNameByProperty('高二|月考试卷|福建|2012年')}} 试卷类型:{{getTestPaperTypeName('高二|月考试卷|福建|2012年')}} 使用省份:{{getAreaName('高二|月考试卷|福建|2012年')}}
试卷年份:{{getYear('高二|月考试卷|福建|2012年')}}上传日期:2012-03-15题数:25
提示:单击题文可显示答案与解析。
题号:1235198
题型:选择题
难易度:一般
日期:2016-12-01
来源:2011-2012学年福建省永定一中高二下学期第一次阶段考化学试卷
【题文】下列说法正确的是
| A.液态HCl、固态NaCl均不导电,所以HCl、NaCl是非电解质 |
| B.NH3、CO2、Cl2的水溶液均能导电,所以NH3、CO2、Cl2均是电解质 |
| C.蔗糖、酒精在液态或水溶液里均不导电,所以它们是非电解质 |
| D.铜、石墨均导电,所以它们是电解质 |
题号:3189538
题型:选择题
难易度:一般
日期:2015-12-14
来源:2011-2012学年福建省永定一中高二下学期第一次阶段考化学试卷
【题文】常温下,将0.1 mol·L
-1氢氧化钠溶液与0.06 mol·L
-1硫酸溶液等体积混合,该混合溶液的pH等于
题号:3214678
题型:选择题
难易度:一般
日期:2015-03-11
来源:2011-2012学年福建省永定一中高二下学期第一次阶段考化学试卷
【题文】下列说法正确的是
| A.1 mL浓氨水加水稀释至l00mL后,溶液中n(OH-)减少 |
| B.NaHCO3完全分解后的固体溶于水,所得溶液中不存在HCO3- |
| C.常温下,pH=3的醋酸和pH=11的NaOH溶液等体积混合后,溶液的pH<7 |
| D.常温下,向NH4Cl溶液中加入氨水至溶液的pH=7,此时溶液中c(NH4+)>c(C1-) |
题号:3214683
题型:选择题
难易度:一般
日期:2015-03-11
来源:2011-2012学年福建省永定一中高二下学期第一次阶段考化学试卷
【题文】有关常温下pH均为3的醋酸溶液和盐酸的说法正确的是
| A.两种溶液中,由水电离出的氢离子浓度均为l×10-11 mol·L-1 |
| B.分别加水稀释100倍后,两种溶液的pH仍相等 |
| C.中和同体积的这两种酸溶液所需要NaOH物质的量也相等 |
| D.分别加入足量锌片,两种溶液生成H2的体积相等 |
题号:3214694
题型:选择题
难易度:较易
日期:2015-03-11
来源:2011-2012学年福建省永定一中高二下学期第一次阶段考化学试卷
【题文】下列溶液一定呈酸性的是
| A.c(OH-)<c(H+)的溶液 | B.含有较多H+的溶液 |
| C.pH<7的溶液 | D.滴加酚酞显无色溶液 |
题号:3214696
题型:选择题
难易度:一般
日期:2015-03-11
来源:2011-2012学年福建省永定一中高二下学期第一次阶段考化学试卷
【题文】在0.10mol·L
-1NH
3·H
2O溶液中,加入少量NH
4Cl晶体后,引起的变化是
| A.NH3·H2O的电离程度减小 | B.NH3·H2O的电离常数增大 |
| C.溶液的导电能力不变 | D.溶液的pH增大 |
题号:3297388
题型:选择题
难易度:一般
日期:2012-03-15
来源:2011-2012学年福建省永定一中高二下学期第一次阶段考化学试卷
【题文】已知,常温下,
KSP(AgCl)=1.8×10
-10 mol
2·L
-2,
KSP(AgI)=8.3×10
-17 mol
2·L
-2,下列叙述中,正确的是
A.常温下,AgCl在饱和NaCl溶液中的KSP比在纯水中的KSP小
| B.向AgCl的悬浊液中加入KI溶液,沉淀由白色转化为黄色
| C.将0.001 mol·L-1的AgNO3溶液滴入KCl和KI的混合溶液中,一定先产生AgI沉淀
| D.向AgCl的饱和溶液中加入NaCl晶体,有AgCl析出且溶液中c(Ag+)=c(Cl- |
题号:3297389
题型:选择题
难易度:一般
日期:2012-03-15
来源:2011-2012学年福建省永定一中高二下学期第一次阶段考化学试卷
【题文】下列有关0.1 mol?L-1NaHCO3溶液中离子浓度的关系式,正确的是
| A.c(Na+)> c(HCO3-)> c(CO32-)> c(H+)> c(OH-) |
| B.c(Na+)> c(CO32-)> c(HCO3-)> c(OH-)> c(H+) |
| C.c(Na+)= c(HCO3-) + 2c(CO32-) + c(H2CO3 |
| D.c(Na+) + c(H+)= c(HCO3-) + 2c(CO32-) + c(OH-) |
题号:3297390
题型:选择题
难易度:一般
日期:2012-03-15
来源:2011-2012学年福建省永定一中高二下学期第一次阶段考化学试卷
【题文】下列各溶液中,微粒的物质的量浓度关系正确的是
| A.Na2CO3溶液:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| B.NH4Cl溶液:c(NH4+)=c(Cl-) |
| C.硝酸钠与稀盐酸的混合溶液:c(Na+)=c(NO3-) |
| D.等体积等浓度的氢氧化钠与醋酸混合:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
题号:3297391
题型:选择题
难易度:容易
日期:2012-03-15
来源:2011-2012学年福建省永定一中高二下学期第一次阶段考化学试卷
【题文】常温下,将等物质的量浓度、等体积的烧碱溶液和乙酸溶液混合,充分反应后溶
液的pH
题号:3297392
题型:选择题
难易度:容易
日期:2012-03-15
来源:2011-2012学年福建省永定一中高二下学期第一次阶段考化学试卷
【题文】已知25℃时,下列酸的电离常数:
醋酸(CH
3COOH):1.75×10-5 氢氰酸(HCN):4.93×10-10
氢氟酸(HF):7.2×10-4 甲酸(HCOOH):1.77×10-4
物质的量浓度均为0.1mol?L-1的上述溶液,酸性最强的是
题号:3297393
题型:选择题
难易度:较易
日期:2012-03-15
来源:2011-2012学年福建省永定一中高二下学期第一次阶段考化学试卷
【题文】一定温度下,往纯水中加入少量下列物质。当物质溶于水(或与水反应)后,水的电离可能不受影响的是
题号:3297394
题型:选择题
难易度:
日期:2012-03-15
来源:2011-2012学年福建省永定一中高二下学期第一次阶段考化学试卷
【题文】下列离子方程式中,正确的是( )
A.氯气通入水中,溶液呈酸性:Cl2 + H2O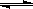 2H+ + Cl- + ClO- 2H+ + Cl- + ClO- |
| B.酚酞滴入碳酸钠溶液中,溶液变红:CO32- + H2O=HCO3- + OH- |
| C.碳酸氢铵溶液与足量氢氧化钠溶液反应:NH4+ + OH-=H2O + NH3↑ |
| D.二氧化硫通入溴水中,溴水褪色:SO2 + Br2 + 2H2O=4H+ + 2Br- + SO42- |
题号:4339037
题型:选择题
难易度:
日期:2012-03-15
来源:2011-2012学年福建省永定一中高二下学期第一次阶段考化学试卷
【题文】将浓度为0.1mol·L
-1HF溶液加水不断稀释,下列各量始终保持增大的是
| A.c(H+) | B.Ka(HF) | C.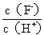 | D.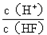 |
题号:4339040
题型:选择题
难易度:
日期:2012-03-15
来源:2011-2012学年福建省永定一中高二下学期第一次阶段考化学试卷
【题文】室温下,水的电离达到平衡:H
2O

H
++OH
-。下列叙述正确的是
| A.将水加热,平衡向正反应方向移动,Kw不变 |
| B.向水中加入少量盐酸,平衡向逆反应方向移动,c(H+)增大 |
| C.向水中加入少量NaOH固体,平衡向逆反应方向移动,c(OH-)降低 |
| D.向水中加入少量CH3COONa固体,平衡向正反应方向移动,c(OH-)=c(H+) |
题号:4339042
题型:选择题
难易度:
日期:2012-03-15
来源:2011-2012学年福建省永定一中高二下学期第一次阶段考化学试卷
【题文】对滴有酚酞试液的下列溶液,操作后颜色变深的是( )
| A.明矾溶液加热 |
| B.CH3COONa溶液加热 |
| C.氨水中加入少量NH4Cl固体 |
| D.小苏打溶液中加入少量NaCl固体 |
题号:4339043
题型:选择题
难易度:
日期:2012-03-15
来源:2011-2012学年福建省永定一中高二下学期第一次阶段考化学试卷
【题文】下列说法正确的是
A.常温下0.4 mol/L HB溶液和0.2 mol/L NaOH溶液等体积混合后溶液的pH=3,
则混合溶液中离子浓度的大小顺序为: c(B—)>c(H+)>c(Na+)>c(OH—)
B.常温时,pH=2的CH3COOH溶液和HCl溶液、pH=12的氨水和NaOH溶液,四种
溶液中由水电离的c(H+)相等
C.常温下0.1 mol/L的下列溶液①NH4Al(SO4)2②NH4Cl③NH3·H2O④CH3COONH4中,
c(NH4+)由大到小的顺序是:②>①>④>③
D.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
题号:4339045
题型:选择题
难易度:
日期:2012-03-15
来源:2011-2012学年福建省永定一中高二下学期第一次阶段考化学试卷
【题文】根据以下叙述制备氯化铜:先将浓盐酸用蒸气加热至80℃左右,慢慢加入含有FeO杂质的CuO粉,充分反应,使其溶解。已知:FeS不溶于水,但溶于酸;
溶液中被沉淀离子
| Fe3+
| Fe2+
| Cu2+
|
完全生成氢氧化物沉淀时,溶液的pH
| ≥3.7
| ≥9.6
| ≥6.4
|
在除去溶液中的Fe
2+时,可采用的方法是
A.可直接加碱,调整溶液的pH≥9.6
B.加入纯铜粉,将Fe
2+还原为Fe
C.先将Fe
2+氧化成Fe
3+,再调整溶液pH至3~4
D.通入H
2S使Fe
2+直接沉淀
题号:4339047
题型:选择题
难易度:
日期:2012-03-15
来源:2011-2012学年福建省永定一中高二下学期第一次阶段考化学试卷
【题文】下列各组离子因发生氧化还原反应而不能大量共存的是( )
| A.H+、Fe2+、NO3-、SO42- |
| B.Ca2+、H+、SO42-、HCO3- |
| C.Na+、Cu2+、Cl-、S2- |
| D.Fe3+、K+、SCN-、Cl- |
题号:3297385
题型:填空题
难易度:一般
日期:2012-03-15
来源:2011-2012学年福建省永定一中高二下学期第一次阶段考化学试卷
【题文】(8分)硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:
H
2SO
4=H
++HSO
4—, HSO
4 
H
++SO
42—。
请回答下列有关问题:
(1)Na
2SO
4溶液呈
填“弱酸性”、“中性”或“弱酸性”);
(2)H
2SO
4溶液与BaCl
2溶液反应的离子方程式为
;
(3)在0.10mol·L
—1的Na
2SO
4溶液中,下列离子浓度关系正确的是
(填写编号)
| A.c(Na+)=c(SO42—)+c(HSO4—)+c(H2SO4) |
| B.c(OH—)=c(HSO4—)+c(H+) |
| C.c(Na+)+c(H+)=c(OH—)+c(HSO4—)+2c(SO42—) |
| D.c(Na+)="2" c(SO42—)+2 c(HSO4—) |
(4)写出NaHSO
4溶液中溶质电离常数(K
a)的表达式
;
题号:3297386
题型:填空题
难易度:一般
日期:2012-03-15
来源:2011-2012学年福建省永定一中高二下学期第一次阶段考化学试卷
【题文】(12分)某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。

(1)滴定:①用
式滴定管盛装
camol/L盐酸标准液。右图
表示某次滴定时50 mL滴定管中前后液面的位置。请将用去的
标准盐酸的体积填入③表空格中。滴定管中剩余液体的体积
25.10mL(填大于、小于或者等于)。
②下表是3种常见指示剂的变色范围:
指示剂
| 石蕊
| 甲基橙
| 酚酞
|
变色范围(pH)
| 5.0—8.0
| 3.1—4.4
| 8.2—10.0
|
该实验可选用
作指示剂;
③有关数据记录如下:
滴定序号
| 待测液体积(mL)
| 所消耗盐酸标准液的体积(mL)
|
滴定前
| 滴定后
| 消耗的体积
|
1
| V
| 0.50
| 25.12
| 24.62
|
2
|  V V
|
|
|
|
3
| V
| 6.00
| 30.58
| 24.58
|
(2)根据所给数据,写出计算烧碱样品的物质的量浓度的表达式(不必化简)
cb=
。
(3)下列几种情况会使测定结果偏高的是
a.若滴定前用蒸馏水冲洗锥形瓶;
b.读数时,若滴定前仰视,滴定后俯视;
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外;
d.若未充分振荡,刚看到溶液变色,立刻停止滴定。
题号:3297387
题型:填空题
难易度:一般
日期:2012-03-15
来源:2011-2012学年福建省永定一中高二下学期第一次阶段考化学试卷
【题文】(10分)常温下有浓度均为0.5mol/L的四种溶液:①Na2CO3②NaHCO3③HCl ④NH3?H2O(1)上述溶液中,可发生水解的是 (填序号,下同)。
(2)上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度大到小的
顺序为 。
(3)向溶液④中加入少量氯化铵固体,此时c(NH4+)/c(OH-)的值 (填增大、
减小、不变)。
(4)若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积 ④的体积(填
大于、小于、等于)。
(5)取10mL溶液③,加水稀释到500mL,则该溶液中由水电离出的c(H+)= 。
题号:3890734
题型:填空题
难易度:一般
日期:2013-10-12
来源:2011-2012学年福建省永定一中高二下学期第一次阶段考化学试卷
【题文】(12分)蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
I.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤;并在常温常压下结晶,制得粗硫酸镁
(其中常含有少量Fe
3+、Al
3+、Fe
2+等杂质离子)。
II.提纯粗硫酸镁:将粗硫酸镁在酸性条件下溶解,加入适量的0.1 mol/L H
2O
2溶液,再
调节溶液pH至7~8,并分离提纯。
III.制取氢氧化镁:向步骤II所得溶液中加入过量氨水。
已知:金属离子氢氧化物沉淀所需pH
| Fe3+
| Al3+
| Fe2+
| Mg2+
|
开始沉淀时
| 1.5
| 3.3
| 6.5
| 9.4
|
沉淀完全时
| 3.7
| 5.2
| 9.7
| 12.4
|
请回答:
(1)步骤II中,可用于调节溶液pH至7~8的最佳试剂是
(填字母序号)。
A. MgO B. Na
2CO
3 C.蒸馏水
(2)工业上,常通过测定使铁氰化钾(K
3[Fe(CN)
6])溶液不变色所需H
2O
2溶液的量来确
定粗硫酸镁中Fe
2+的含量。已知,测定 123 g粗硫酸镁样品所消耗的0.1 mol/L H
2O
2溶液的体积如下表所示。
| 平行测定数据
| 平均值
|
实验编号
| 1
| 2
| 3
| 4
|
消耗H2O2溶液的体积/mL
| 0.32
| 0.30
| 0.30
| 0.32
| 0.31
|
Fe
2+与H
2O
2溶液反应的离子方程式为
。
(3)工业上常以Mg
2+的转化率为考察指标,确定步骤III制备氢
氧化镁工艺过程的适宜条件。其中,反应温度与Mg
2+转化率
的关系如右图所示。
根据图中所示 50℃前温度与Mg
2+转化率之间的关系,可判 断此反应是
(填“吸热”或“放热”)反应。
②图中,温度升高至 50℃以上Mg
2+转化率下降的可能原因 是
。
③
Ksp表示沉淀溶解平衡的平衡常数。已知:
Mg(OH)
2(s)

Mg
2+ (aq)+ 2OH
- (aq)
Ksp =
c(Mg
2+)·
c2( OH
-) = 5.6×10
-12Ca(OH)
2(s)

Ca
2+ (aq) + 2OH
- (aq)
Ksp =
c(Ca
2+)·
c2(OH
-) = 4.7×10
-6若用石灰乳替代氨水,
(填“能”或“不能”)制得氢氧化镁,理由是
。
题号:4339048
题型:填空题
难易度:
日期:2012-03-15
来源:2011-2012学年福建省永定一中高二下学期第一次阶段考化学试卷
【题文】(8分)
(1)常温下,0.1 mol/L的醋酸和0.1 mol/L的盐酸各100 mL,分别与足
量的锌粒反应,产生的气体体积前者__________后者(填“<”“>”或“=”)。
(2)在25 ℃条件下将pH=5的氯化铵溶液稀释100倍,稀释后溶液的pH为(填选项字
母,下同)__________。
A.5 B.7 C.3~5之间 D.5~7之间
(3)25 ℃时,向0.1 mol/L的醋酸溶液中加入少量醋酸钠晶体,当晶体溶解后测得溶
液pH将__________。
A.增大 B.减小 C.不变 D.无法确定
(4)室温下,向0.1 mol/L的H2SO4中加入足量的锌粒,若想减慢H2产生的速率,但又
不影响H2的体积,可以向硫酸溶液中加入__________试剂。
A.碳酸钠晶体 B.醋酸钠晶体 C.滴加少量硫酸铜溶液 D.水
题号:4339049
题型:填空题
难易度:
日期:2012-03-15
来源:2011-2012学年福建省永定一中高二下学期第一次阶段考化学试卷
【题文】(12分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
实验编号
| HA物质的量浓度(mol·L-1)
| NaOH物质的量浓度(mol·L-1)
| 混合溶液的pH
|
甲
| 0.2
| 0.2
| pH=a
|
乙
| c
| 0.2
| pH=7
|
丙
| 0.2
| 0.1
| pH>7
|
丁
| 0.1
| 0.1
| pH=9
|
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸_________________________________________________________。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2________
(选填“是”或“否”)。
(3)丙组实验结果分析,HA是________酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是________________________________
(4)丁组实验所得混合溶液中由水电离出的c(OH
-)=________mol·L
-1。
写出该混合溶液中下式的精确结果(不能做近似计算)。
c(Na
+)-c(A
-)=________mol·L
-1
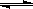 2H+ + Cl- + ClO-
2H+ + Cl- + ClO-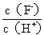
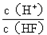
 H++OH-。下列叙述正确的是
H++OH-。下列叙述正确的是 H++SO42—。
H++SO42—。
 V
V Mg2+ (aq)+ 2OH- (aq) Ksp = c(Mg2+)·c2( OH-) = 5.6×10-12
Mg2+ (aq)+ 2OH- (aq) Ksp = c(Mg2+)·c2( OH-) = 5.6×10-12 Ca2+ (aq) + 2OH- (aq) Ksp = c(Ca2+)·c2(OH-) = 4.7×10-6
Ca2+ (aq) + 2OH- (aq) Ksp = c(Ca2+)·c2(OH-) = 4.7×10-6