适用年级:{{getGradeNameByProperty('高三|月考试卷|福建|2011年')}} 试卷类型:{{getTestPaperTypeName('高三|月考试卷|福建|2011年')}} 使用省份:{{getAreaName('高三|月考试卷|福建|2011年')}}
试卷年份:{{getYear('高三|月考试卷|福建|2011年')}} 上传日期:2011-12-12 题数:19
题号:3296231
题型:选择题
难易度:较易
日期:2012-04-15
来源:2012届福建省厦门外国语学校高三11月月考化学试卷
【题文】某学生运用所学知识研究钠的性质:将一粒金属钠和一块铜片分别盛在表面皿中,来研究它们在空气中的稳定性。该学生采用的研究方法是:( )
①假说法 ②实验法 ③分类法 ④比较法
题号:3304287
题型:选择题
难易度:一般
日期:2011-12-12
来源:2012届福建省厦门外国语学校高三11月月考化学试卷
【题文】室温时,将xmL,pH=a的稀NaOH
溶液与ymL pH=b的稀盐酸充分反应。下列前于反应溶液pH的判断,正确的是
A 若x=y,且a+b=14,则pH>7 B 若10x=y,且a+b=13,则pH=7
C 若ax=by,且a+b=13,则pH=7 D 若x=10y,且a+b=14,则pH>7
题号:3304288
题型:选择题
难易度:较易
日期:2011-12-12
来源:2012届福建省厦门外国语学校高三11月月考化学试卷
【题文】下表中物质的分类组合完全正确的是
题号:3304289
题型:选择题
难易度:较易
日期:2011-12-12
来源:2012届福建省厦门外国语学校高三11月月考化学试卷
【题文】化学反应前后肯定没有变化的是
①原子数目 ②分子数目 ③元素种类 ④物质的总质量 ⑤物质的种类
题号:3304290
题型:选择题
难易度:一般
日期:2011-12-12
来源:2012届福建省厦门外国语学校高三11月月考化学试卷
【题文】下列实验中,由于错误操作导致所测出的数据一定偏低的是
A.用量筒量取一定体积液体时,俯视读出的读数 B.用标准盐酸滴定氢氧化钠溶液测碱液浓度时,酸式滴定管洗净后,没有用标准盐酸润洗,直接着装标准盐酸滴定碱液,所测出的碱液的浓度值 C.测定硫酸铜晶体结晶水含量时,加热温度太高使一部分硫酸铜发生分解,所测出的结晶水的含量 D.做中和热测定时,在大小烧杯之间没有垫碎泡沫塑料(或纸条)所测出的中和热数值
题号:3304291
题型:选择题
难易度:一般
日期:2011-12-12
来源:2012届福建省厦门外国语学校高三11月月考化学试卷
【题文】下列溶液中各微粒的浓度关系一定正确的是
A.某酸性溶液中只含NH4 + 、Cl- 、H+ 、OH- 四种离子,则溶液中:c (Cl- )>c (H+ )>c (NH4 + )>c (OH- ) B.在Na2 CO3 和NaHCO3 的混合溶液中:c (Na+ )+c (H+ )=c (HCO3 - )+c (OH- )+c (CO3 2 - ) C.将0.1 mol CuSO4 ·(NH4 )2 SO4 ·6H2 O溶于水配成的1 L溶液中:c (SO4 2 - )>c (NH4 + )>c 2 + )>c (H+ )>c (OH- ) D.等体积、等浓度的NaX溶液和弱酸HX溶液的混合后的溶液中:
c (Na
+ )>
c (HX)>
c (X
- )>
c (H
+ )>
c (OH
- )
题号:3304292
题型:选择题
难易度:一般
日期:2011-12-12
来源:2012届福建省厦门外国语学校高三11月月考化学试卷
【题文】物质的量浓度相等的下列溶液pH值由大到小的顺序是
A.Na2 CO3 、NaHCO3 、NaCl、NH4 Cl B.Na2 CO3 、NaHCO3 、NH4 Cl、NaCl、 C.Na2 CO3 、NaCl、NH4 Cl、NaHCO3 D.Na2 CO3 、NH4 Cl、NaHCO3 、NaCl、
题号:3304293
题型:选择题
难易度:一般
日期:2011-12-12
来源:2012届福建省厦门外国语学校高三11月月考化学试卷
【题文】在试管中注入某浅红色溶液,给试管加热,溶液红色加深。则原溶液可能是
①滴有石蕊的H
2 SO
4 溶液 ②滴有石蕊的NH
4 Cl溶液
③滴有酚酞的氨水溶液 ④滴有酚酞的Na
2 CO
3 溶液
A.①② B.③ C.①③ D.②④
题号:4345146
题型:选择题
难易度:一般
日期:2013-03-14
来源:2012届福建省厦门外国语学校高三11月月考化学试卷
题号:4345147
题型:选择题
难易度:一般
日期:2012-03-12
来源:2012届福建省厦门外国语学校高三11月月考化学试卷
【题文】向三份0.1 mol·L
- 1 CH
3 COONa溶液中分别加入少量NH
4 NO
3 、Na
2 SO
3 、FeCl
2 固体(忽略溶液体积变化),则CH
3 COO
- 浓度的变化依次为
A.减小、增大、减小 B.增大、减小、减小 C.减小、增大、增大 D.增大、减小、增大
题号:4345148
题型:选择题
难易度:一般
日期:2013-01-04
来源:2012届福建省厦门外国语学校高三11月月考化学试卷
【题文】为了配制NH
4 + 与Cl
- 的浓度比为1:1的溶液,可在NH
4 Cl溶液中加入
①适量NH
4 NO
3 ②适量NaCl ③适量氨水 ④适量NaOH
题号:4345149
题型:选择题
难易度:较易
日期:2013-05-21
来源:2012届福建省厦门外国语学校高三11月月考化学试卷
【题文】下列实验操作中错误的是
A.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 B.蒸馏时,应使温度计水银球靠近蒸烧瓶支管口 C.滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼 D.称量时,称量物放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘中
题号:4345150
题型:选择题
难易度:一般
日期:2011-12-12
来源:2012届福建省厦门外国语学校高三11月月考化学试卷
【题文】已知298K时,Mg(OH)
2 的溶度积常数Ksp=5.6×10
-12 ,取适量的MgCl
2 溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是
A.所得溶液中的c(H+ )=1.0×10-13 mol·L-1 B.所得溶液中由水电离产生的c(OH- )=1.0×10-13 mol·L-1 C.所加的烧碱溶液pH=13.0 D.所得溶液中的c(Mg2+ )=5.6×10-10 mol·L-1
题号:4345152
题型:选择题
难易度:
日期:2011-12-12
来源:2012届福建省厦门外国语学校高三11月月考化学试卷
【题文】下列实验操作中,先后顺序正确的是
A 稀释浓硫酸时,先在烧杯中加入一定体积的浓硫酸,后注入蒸馏水
B 为测定硫酸铜晶体的结晶水含量,称样时,先称取一定量的晶体,后放入坩埚
C 为检验酸性溶液
中的Cl
- 和SO
4 2 - ,先加硝酸银溶液,滤去沉淀后硝酸钡溶液
D 在制取干燥纯净的氯气时,先使氯气通过水(或饱和食盐水),后通过浓硫酸
题号:4345153
题型:选择题
难易度:
日期:2011-12-12
来源:2012届福建省厦门外国语学校高三11月月考化学试卷
【题文】将pH=1的盐酸平均分成2份,l份加适量水,另1份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比为
A.9 B.10 C.11 D
.12
题号:3304284
题型:实验题
难易度:一般
日期:2011-12-12
来源:2012届福建省厦门外国语学校高三11月月考化学试卷
【题文】(14分)某校化学课外活动小组利用下面所提供的仪器装置和药品制取NaHCO
3 溶液,设计如下实验。实验室提供的药品、仪器装置如下:
药品:①2%NaOH溶液 ②稀HCl ③稀H
2 SO
4 ④饱和KHCO
3 溶液 ⑤浓H
2 SO
4 ⑥CaCO
3 固体 ⑦K
2 CO
3 粉末
仪器装置(如图所示):
请根据题目要求回答下列问题:
(2)如何检验所选择的CO
2 发生装置(X)的气密性,请写出主要操作过程:
。
(3)将装置按X、Y、Z顺序连接并检查气密性后,当加入药品实验时,X装置中发生化学反应的离子方程式为
,Y装置中除去的杂质为
。
(4)常温下,向Z装置的NaOH溶液中通入过量CO
2 气体,其原因是
;通入
过量CO
2 后,Z装置内的溶液中离子浓度大小顺序为
;若要保证乙装置中不析出晶体(不考虑过饱和溶液问题),NaOH溶液最大浓度不能超过
%(质量分数)。
附:有关物质在常温(20℃)时的溶解度
化学式 Na2 CO3 NaHCO3 NaOH NaCl Na2 SO4 溶解度(g/100gH2 O) 21.3 9.60 107 35.8 19.4
题号:3304286
题型:实验题
难易度:一般
日期:2011-12-12
来源:2012届福建省厦门外国语学校高三11月月考化学试卷
【题文】(13分)有一固体样品,其中只含有Na
2 CO
3 •10H
2 O和NaH
CO
3 .为了测定样品中Na
2 CO
3 的质量分数,请从下图中选用适当的实验装置,设计一个最简单的实验,测定固体样品中Na
2 CO
3 的质量分数。
请填写下列各空:
(1)应选用的装置是(只写装置的代号,装置不重复)_________________,所选用装置的连接顺序是(填接口的字母):_______接_______,_______接_______,_______接_______ ……。
(2)装置⑥中应盛放的试剂是__________________,其作用是_____________________。
(3)选用
的装置连接好后,最后一个装置的作用是_______________________________。
(4)写出吸收CO
2 的离子方程式____________________________________。
(5)停止加热时,正确的操作是____________________________________。
(6)取m g固体样品实验,经测定m g固体样品在加热时,完全分解,可得agCO
2 ,则m g样品中所含。Na
2 CO
3 的质量分数为________________________________。(用含m、a的代数式表示)
题号:3304285
题型:填空题
难易度:较难
日期:2011-12-12
来源:2012届福建省厦门外国语学校高三11月月考化学试卷
【题文】(16分)运用相关原理,回答下列各小
题:
Ⅰ.已知NaHSO
4 在水中的电离方程式为NaHSO
4 =Na
+ + H
+ + SO
4 2 - 。
(1)在NaHSO
4 溶液中c(H
+ )
c(OH
- )+ c(SO
4 2 - )(填“>”、“=”或“<
”
下同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO
4 2 - 完全沉淀,则反应后溶液的pH
7。
(2)将
20mLpH=2的NaHSO
4 溶液逐滴加入到20mL 0.1 mol·L
- 1 Na
2 CO
3 溶液中,溶液中发生反应的离子方程式为:
;向此反应后的溶液中滴加
0.001 mol·L
- 1 BaCl
2 溶液,首先析出的沉淀是
。[K
SP (BaSO
4 )=1.1×10
-10 mol
2 ·L
-2 ;K
SP (BaCO
3 )=5.1×10
-9 mol
2 ·L
-2 ]
Ⅱ.已知:在25时 H
2 O
H
+ +OH
- K
W =10
-14 CH
3 COOH
H
+ +CH
3 COO
- - > Ka=1.8×10
-5 (3)醋酸钠水解的平衡常数K
h 的表达式为
。当升高温度时,K
h 将
(填“增大”“减小”“不变”);
(4)0.5mol·L
-1 醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)
为a;1mol·L
-1 醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为
,a与b的关系为
(填“大于”“小于”“等于”);
(5)0.9mol·L
-1 醋酸钠溶液中[OH
- ]=
mol·L
-1 在某溶液中含Mg
2+ 、Cd
2+ 、Zn
2+ 三种离子的浓度均为0.01mol·L
-1 。向其中加入固体醋酸钠,使其浓度为0.9mol·L
-1 ,以上三种金属离子中
能生成沉淀,原因是
。
(K
SP [Mg(OH)
2 ]=1.8×10
-11 、K
SP [Zn(OH)
2 ]=1.2×10
-17 、
K
SP [Cd(OH)
2 ]=2.5×10
-14 、
=2.2)
题号:4345151
题型:填空题
难易度:一般
日期:2012-07-13
来源:2012届福建省厦门外国语学校高三11月月考化学试卷
【题文】(12分)现有A、B、C、D、E五种可溶强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
阳离子 H+ 、Na+ 、Al3+ 、Ag+ 、Ba2+ 阴离子 OH— 、Cl— 、CO3 2— 、NO3 — 、SO4 2—
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②向E溶液中逐滴滴加B溶液至过量,沉淀量先增加后减少但不消失。
③D溶液与另外四种溶液反应都能产生沉淀。
试回答下列问题:
(1)A溶液呈碱性的原因是
。
(2)写出E溶液与过量的B溶液反应的离子方程式
。
(3)已知:NaOH(aq)+HNO
3 (aq)=NaNO
3 (aq)+H
2 O(1);△H=" —a" kJ·mol-1。
请写出相同条件下B与C的稀溶液反应的热化学方程式
。
(4)若25°时C、E溶液pH=4,则E溶液中水电离出的氢离子浓度是C溶液中水电离出的氢离子浓度
倍。
(5)将C溶液逐滴加入等体积、等物质的量的浓度的A溶液中,反应后溶液中一价离子(+1或一1)浓度由大到小的顺序为
: 。
 溶液与ymL pH=b的稀盐酸充分反应。下列前于反应溶液pH的判断,正确的是
溶液与ymL pH=b的稀盐酸充分反应。下列前于反应溶液pH的判断,正确的是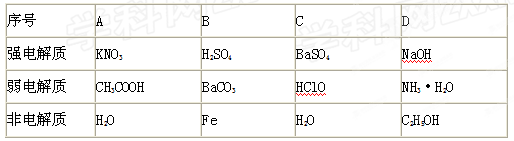
 (Cu2+)>c(H+)>c(OH-)
(Cu2+)>c(H+)>c(OH-) ④
④ 下列反应,其中属于盐类水解反应的是
下列反应,其中属于盐类水解反应的是  NH3·H2O+H3O+
NH3·H2O+H3O+  H3O+ + C
H3O+ + C O32-
O32- H++Cl-+HClO
H++Cl-+HClO
 睛注视滴定管中的液面
睛注视滴定管中的液面 中的Cl-和SO42-,先加硝酸银溶液,滤去沉淀后硝酸钡溶液
中的Cl-和SO42-,先加硝酸银溶液,滤去沉淀后硝酸钡溶液 .12
.12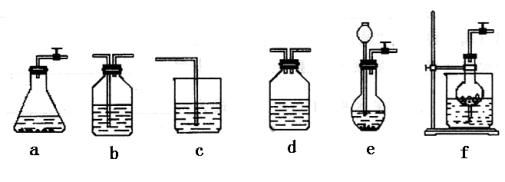
 过量CO2后,Z装置内的溶液中离子浓度大小顺序为 ;若要保证乙装置中不析出晶体(不考虑过饱和溶液问题),NaOH溶液最大浓度不能超过 %(质量分数)。
过量CO2后,Z装置内的溶液中离子浓度大小顺序为 ;若要保证乙装置中不析出晶体(不考虑过饱和溶液问题),NaOH溶液最大浓度不能超过 %(质量分数)。 CO3•10H2O和NaH
CO3•10H2O和NaH CO3.为了测定样品中Na2CO3的质量分数,请从下图中选用适当的实验装置,设计一个最简单的实验,测定固体样品中Na2CO3的质量分数。
CO3.为了测定样品中Na2CO3的质量分数,请从下图中选用适当的实验装置,设计一个最简单的实验,测定固体样品中Na2CO3的质量分数。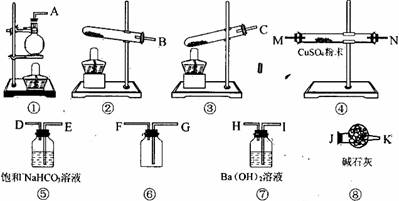
 的装置连接好后,最后一个装置的作用是_______________________________。
的装置连接好后,最后一个装置的作用是_______________________________。 题:
题: 2-。
2-。 ”
” 下同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH 7。
下同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH 7。 20mLpH=2的NaHSO4溶液逐滴加入到20mL 0.1 mol·L-1Na2CO3溶液中,溶液中发生反应的离子方程式为: ;向此反应后的溶液中滴加
20mLpH=2的NaHSO4溶液逐滴加入到20mL 0.1 mol·L-1Na2CO3溶液中,溶液中发生反应的离子方程式为: ;向此反应后的溶液中滴加 H++OH- KW=10-14
H++OH- KW=10-14 
 H++CH3COO--> Ka=1.8×10-5
H++CH3COO--> Ka=1.8×10-5
 为a;1mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 (填“大于”“小于”“等于”);
为a;1mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 (填“大于”“小于”“等于”);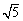 =2.2)
=2.2)