适用年级:{{getGradeNameByProperty('高三|月考试卷|福建|2011年')}} 试卷类型:{{getTestPaperTypeName('高三|月考试卷|福建|2011年')}} 使用省份:{{getAreaName('高三|月考试卷|福建|2011年')}}
试卷年份:{{getYear('高三|月考试卷|福建|2011年')}}上传日期:2011-12-14题数:20
提示:单击题文可显示答案与解析。
题号:3277651
题型:选择题
难易度:容易
日期:2013-03-12
来源:2012届福建省四地六校高三第三次月考化学试卷
【题文】逻辑推理是化学学习中常用的一种思维方法,以下推理中正确的是( )
| A.单质都是由同种元素组成的,只含一种元素的物质一定是纯净物 |
| B.金属铝排在金属活动性顺序表中氢元素的前面,铝与酸反应一定放出氢气 |
| C.中和反应都有盐和水生成,有盐和水生成的反应都属于中和反应 |
| D.氧化物中都含有氧元素,含氧元素的化合物不一定是氧化物 |
题号:3279077
题型:选择题
难易度:较难
日期:2013-01-21
来源:2012届福建省四地六校高三第三次月考化学试卷
【题文】下列离子方程式正确的是( )
| A.石灰石溶于醋酸: CaCO3 + 2CH3COOH = 2CH3COO-+ Ca2+ + CO2↑+ H2O |
| B.钠与硫酸铜溶液反应: Cu2+ + 2Na = 2Na+ + Cu |
| C.铁屑溶于过量稀硝酸:3Fe + 8H+ + 2NO3-=3Fe2+ + 2NO↑+ 4H2O |
| D.FeCl2溶液中通入少量氯气:Fe2+ + Cl2= Fe3+ + 2Cl- |
题号:3303825
题型:选择题
难易度:一般
日期:2011-12-14
来源:2012届福建省四地六校高三第三次月考化学试卷
【题文】研究硫酸铜的量对锌与稀硫酸反应氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别

加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
实验
混合溶液
| A
| B
| C
| D
| E
| F
|
4mol/L H2SO4/mL
| 30
| V1
| V2
| V3
| V4
| V5
|
饱和 CuSO4溶液/mL CuSO4溶液/mL
| 0
| 0.5
| 2.5
| 5
| V6
| 20
|
H2O/mL
| V7
| V8
| V9
| V10
| 10
| 0
|
下列说法正确的是( )
A. 反应一段时间后,实验A、E中的金属呈暗红色
B. V
1="30," V
6=10
C. 加入MgSO
4与Ag
2SO
4可以起与硫酸铜相同的加速作用
D. 硫酸铜的量越多,产生氢气的速率肯定越快
题号:3303826
题型:选择题
难易度:一般
日期:2011-12-14
来源:2012届福建省四地六校高三第三次月考化学试卷
【题文】下列关系不正确的是( )
| A.离子半径:Cl->F->Na+>Al3+ | B.熔点:石英>食盐>冰>干冰 |
| C.结合氢离子的能力:SO42->SO32->CO32- | D.热稳定性:PH3<H2S<HCl<HF |
题号:3303827
题型:选择题
难易度:较易
日期:2011-12-14
来源:2012届福建省四地六校高三第三次月考化学试卷
【题文】设
NA代表阿伏加德罗常数,下列说法正确的是( )
| A.常温常压下,氧气和臭氧的混合物16g中含有NA个氧原子 |
| B.标准状况下,11.2 LH2O中含分子数为0.5NA |
| C.标准状况下,22.4 LH2中含质子数为NA |
| D.100mL0.1mol·L-1的AlCl3溶液中含有Al3+的个数为0.01 NA |
题号:4337287
题型:选择题
难易度:一般
日期:2012-05-25
来源:2012届福建省四地六校高三第三次月考化学试卷
【题文】在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是
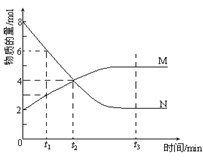
A.反应的化学方程式为:2M N N |
| B.t2时,正逆反应速率相等,达到平衡 |
| C.t3时,正反应速率大于逆反应速率 |
| D.t1时,N的浓度是M浓度的2倍 |
题号:4344803
题型:选择题
难易度:较易
日期:2013-03-27
来源:2012届福建省四地六校高三第三次月考化学试卷
【题文】下列叙述正确的是( )
| A.溶液和胶体的本质区别是有无丁达尔效应 |
| B.玻璃、水泥和光导纤维的主要成分都是硅酸盐 |
| C.常用危险化学品酒精和甲烷的标志都是易燃液体 |
| D.氧化钠和过氧化钠含有的化学键种类不同 |
题号:4344804
题型:选择题
难易度:一般
日期:2012-10-22
来源:2012届福建省四地六校高三第三次月考化学试卷
【题文】对可逆反应N
2 (g)+3H
2(g)
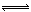
2 NH
3(g),
△H=-92.4 kJ·mol
-1下列叙述正确的是( )
| A.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 |
| B.若单位时间内生成x mol N2的同时,消耗2x molNH3,则反应达到平衡状态 |
| C.达到化学平衡时,2v正(H2)=3v逆(NH3) |
| D.加入催化剂,正反应速率增大,逆反应速率不变 |
题号:4344806
题型:选择题
难易度:较易
日期:2012-10-11
来源:2012届福建省四地六校高三第三次月考化学试卷
【题文】为使反应:Cu+2H
 2
2O===Cu(OH)
2+H
2↑能够发生,下列设计方案正确的是( )
| A.用铜片作负极,石墨电极作正极,氯化钠溶液为电解质溶液构成原电池 |
| B.用铜片作电极,外接直流电源电解硫酸铜溶液 |
| C.用铜片作阳极,铁片作阴极,电解硫酸钠溶液 |
| D.用铜片作阴、阳电极,电解稀硫酸 |
题号:4344807
题型:选择题
难易度:一般
日期:2013-01-22
来源:2012届福建省四地六校高三第三次月考化学试卷
【题文】已知A、B为单质,C为化合物。能实现上述转

化关系的是( )
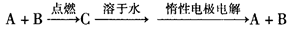
①若C溶于水后得到强碱溶液,则A可能是Na
②若C溶液遇Na
2CO
3,放出CO
2气体,则A可能是H
2③若C溶液中滴加KSCN溶液显红色,则B可能为Fe
④若C溶

液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
A.①② B.②④ C.①③ D.③④
题号:4344808
题型:选择题
难易度:一般
日期:2013-01-22
来源:2012届福建省四地六校高三第三次月考化学试卷
【题文】甲、乙、丙都是短周期

元素,其中甲、乙两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,丙元素原子K层和M层电子数之和与L层的电子数相同.下列判断不正确的是( )
| A.乙元素的族序数比甲元素的族序数大 |
| B.甲、丙两元素最高价氧化物对应水化物的酸性强弱:甲<丙 |
| C.原子半径的大小:甲>乙 |
| D.含乙元素的化合物数目比含甲或丙元素的化合物数目多 |
题号:4344809
题型:选择题
难易度:一般
日期:2013-01-22
来源:2012届福建省四地六校高三第三次月考化学试卷
【题文】已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合下图。则甲和X不可能是( )
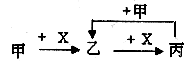
| A.甲为C和X为O2 | B.甲为SO2和X为NaOH溶液 |
| C.甲为Fe和X为Cl2 | D.甲为AlCl3溶液和X为NaOH溶液 |
题号:4344810
题型:选择题
难易度:较难
日期:2013-01-22
来源:2012届福建省四地六校高三第三次月考化学试卷
【题文】根据下图海水综合利用的工业流程图,判断下列说法正确的是( )
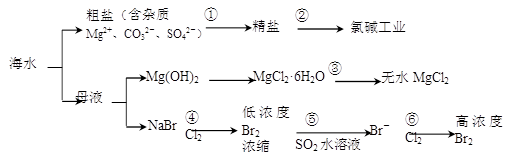
已知:MgCl
2·6H
2O受热生成Mg(OH)Cl和HCl气体等。
| A.过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质 |
| B.在过程③中将MgCl2·6H2O灼烧即可制得无水MgCl2 |
| C.在过程④、⑥反应中每氧化0.2 mol Br-需消耗2. 24 L Cl2 |
| D.过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题 |
题号:4344812
题型:选择题
难易度:一般
日期:2013-01-22
来源:2012届福建省四地六校高三第三次月考化学试卷
【题文】已知1 mol红磷

转化为1 mol白磷,吸收18.39 kJ热量.
4P(红,s)+5O
2(g)===2P
2O
5(s)
ΔH14P(白,s)+5O
2(g)===2P
2O
5(s)
ΔH2则
ΔH1与
ΔH2的关系正确的是( )
| A.ΔH1=ΔH2 | B.ΔH1>ΔH2 | C.ΔH1<ΔH2 | D.无法确定 |
题号:4344813
题型:选择题
难易度:一般
日期:2013-01-21
来源:2012届福建省四地六校高三第三次月考化学试卷
【题文】工业上以CaO和HNO
3为原料制备Ca(NO
3)
2·4H
2O晶体.为了确保制备过程中既不补充水,也无多余水分,所用硝酸溶液溶质的质量分数应为( )
题号:4344814
题型:选择题
难易度:一般
日期:2013-01-22
来源:2012届福建省四地六校高三第三次月考化学试卷
【题文】氰气分子式为(CN)
2,其性质与卤素相似,在化学上称为类卤化合物,以下关于(CN)
2的叙述不正确的是( )
A.可与 活泼金属直接发生化学反应 活泼金属直接发生化学反应 | B.易溶于水也易溶于NaOH溶液 |
| C.是一种有毒气体 | D.可用HCN溶液与MnO2混合加热制取 |
题号:4344815
题型:实验题
难易度:一般
日期:2011-12-14
来源:2012届福建省四地六校高三第三次月考化学试卷
【题文】(14分)下图所示是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去)。请根据下列要求回答问题。
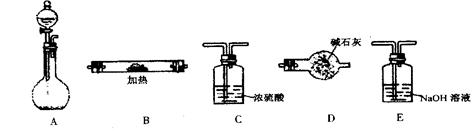
(1)若烧瓶中盛装锌片,分液漏斗中盛装稀硫酸,则:
①当仪器连接顺序为A→C→B→B→D时,两次使用B装置,其中所盛的药品依次是CuO、无水CuSO
4粉末。此实验的目的是
。D装置的作用是
。
②为了使B中CuO反应充分,在不改变现有药品的条件下,可采取的方法有(写一种)
。
③加热前必须进行的

操作是
。
(2)若烧瓶中盛装Na
2O
2固体,分液漏斗中盛装浓氨水,慢慢打开分液漏斗的活塞,则:
①

烧瓶内产生的气体主要有(写化学式)
。
②用产生的气体做氨的催化氧化实验,各仪器装置按气流方向从左到右

连接顺序是(填字母)( )→(

)→( )→E
③试管B中的反应方程式为
题号:3303823
题型:填空题
难易度:一般
日期:2011-12-14
来源:2012届福建省四地六校高三第三次月考化学试卷
【题文】(12分)自洁面料就是在普通的面料纤维中加入一层薄薄的纳米二氧化钛。含有Fe
2O
3的钛铁矿(主要成分为FeTiO
3,Ti的最高价为

+4)制取纳米级TiO
2的流程如下:
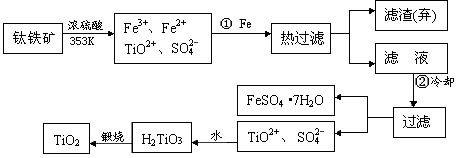
(1)步骤①发生的主要反应是_____
_____
_______(用离子方程式表示)
(2)上述制备二氧化钛的过程中,可以利用的副产物是______________;考虑成本和废物综合利用因素,废液中应加入___________________处理。
(3)由金红石制备单质钛,涉及到的步骤为:
TiO
2
TiCl
4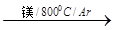
Ti
已知:①C(s)+O
2(g)=CO
2(g)
△H= -393.5kJ·mol
-1②2CO(g)+O
2(g)=2CO
2(g)
△H= -566.0kJ·mol
-1③TiO
2(s)+2Cl
2(g)=TiCl
4(s)+O
2(g)
△H= +141.0kJ·mol
-1则TiO
2(s)+ 2Cl
2(g)+2C(s)=TiCl
4(s)+2CO(g)的
△H=____________ kJ·mol
-1反应TiCl
4+2Mg = 2MgCl
2+Ti 在氩气氛中进行的理由是________________________。
(4)TiO
2是白色粉末,不溶于水,也不溶于酸,但能溶于氢氟酸和热的浓硫酸中。请写出TiO
2与硫酸反应的方程式
题号:3303824
题型:填空题
难易度:一般
日期:2011-12-14
来源:2012届福建省四地六校高三第三次月考化学试卷
【题文】(16分)Ⅰ.短周期元素X、Y、Z、W在元素周期表中的位置如图所示,其中X、Y、Z三种元素的质子数之和为21。
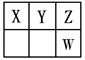
(1)写出W的简单离子的原子结构示意图
;
氢元素与Z形成原子个数比为1∶1的化合物,其结构式为
。
(2)Y的最高价氧化物对应的水化物与Y的氢化物恰好完全反应,生成物的水溶液呈酸性,其原因是(用离子方程式表示)
;
(3)写出Y的最高价氧化物对应水化物的浓溶液与X在加热条件下反应的化学方程式
,
反应中每转移8mol 电子,消耗的还原剂质量为
g。
(4)写出能说明Y的非金属性比Z弱的一个实验事实:
Ⅱ.往1L体积不变的容器中加入0.200mol CO和1.00mol H
2O(g),在t℃时反应:
CO+ H
2O(g)
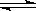
CO
2+ H
2达到平衡,若该反应的化学平衡常数K=1,则t℃时CO 的转化率为
。
Ⅲ.甲醇燃料电池是一种相对理想的绿色能源,可用于电动汽车的电源;若该氢氧燃料电池以硫酸为电解质溶液,总反应为:2CH
3OH + 3O
2= 2CO
2+ 4H
2O,则其正极的电极反应式
题号:4344816
题型:填空题
难易度:一般
日期:2013-01-22
来源:2012届福建省四地六校高三第三次月考化学试卷
【题文】(10分)铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
(1)在一定温度下,氧化亚铁可以与一氧化碳发生下列反应:
Fe
2O
3(s)+3CO(g)
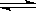
2Fe(s)+3CO
2(g)ΔH>0
①该反应的平衡常数表达式为:K=
②该温度下,在2L盛有
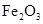
粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为
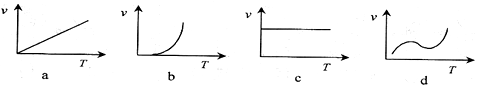
(2)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应。下列反应速率(v)
和温度(T)的关系示意图中与铝热反应最接近的是
。
(3)Fe
3+盐和Al
3+盐在性质上有很多相似的地方,如遇碱都生成难溶的胶状沉淀,可用于净水;也有不同之处,如Fe
3+既有氧化性又有还原性,Al
3+只有氧化性。但Fe
3+只有在碱性介质中才能被氧化为FeO
42-,请完成下列方程式:
Fe(OH)
3 +
ClO
- +
==
FeO
42- +
Cl
- +
;
(4)若将ag Fe和Al的混合物溶于2mol/L的足量的硫酸中,再往溶液中加入足量的6mol/L的NaOH溶液,充分反应,过滤,洗涤,干燥灼烧,称量所得固体的质量仍为ag,则原混合物中Al的质量分数为
 加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。 CuSO4溶液/mL
CuSO4溶液/mL
 N
N 2 NH3(g),△H=-92.4 kJ·mol-1下列叙述正确的是( )
2 NH3(g),△H=-92.4 kJ·mol-1下列叙述正确的是( ) 2O===Cu(OH)2+H2↑能够发生,下列设计方案正确的是( )
2O===Cu(OH)2+H2↑能够发生,下列设计方案正确的是( ) 化关系的是( )
化关系的是( )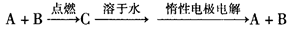
 液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu 元素,其中甲、乙两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,丙元素原子K层和M层电子数之和与L层的电子数相同.下列判断不正确的是( )
元素,其中甲、乙两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,丙元素原子K层和M层电子数之和与L层的电子数相同.下列判断不正确的是( )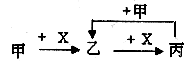

 转化为1 mol白磷,吸收18.39 kJ热量.
转化为1 mol白磷,吸收18.39 kJ热量. 活泼金属直接发生化学反应
活泼金属直接发生化学反应

 操作是 。
操作是 。 烧瓶内产生的气体主要有(写化学式) 。
烧瓶内产生的气体主要有(写化学式) 。 连接顺序是(填字母)( )→(
连接顺序是(填字母)( )→(  )→( )→E
)→( )→E +4)制取纳米级TiO2的流程如下:
+4)制取纳米级TiO2的流程如下:
 TiCl4
TiCl4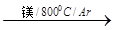 Ti
Ti 
 CO2+ H2达到平衡,若该反应的化学平衡常数K=1,则t℃时CO 的转化率为 。
CO2+ H2达到平衡,若该反应的化学平衡常数K=1,则t℃时CO 的转化率为 。 2Fe(s)+3CO2(g)ΔH>0
2Fe(s)+3CO2(g)ΔH>0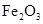 粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为
粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为 