适用年级:{{getGradeNameByProperty('高三|月考试卷|福建|2016年')}} 试卷类型:{{getTestPaperTypeName('高三|月考试卷|福建|2016年')}} 使用省份:{{getAreaName('高三|月考试卷|福建|2016年')}}
试卷年份:{{getYear('高三|月考试卷|福建|2016年')}}上传日期:2016-03-25题数:13
提示:单击题文可显示答案与解析。
题号:3155088
题型:选择题
难易度:较难
日期:2016-03-25
来源:2016届福建省福州八中高三上学期第六次质检化学试卷(带解析)
【题文】室温下,下列溶液中粒子浓度关系不正确的是
| A.pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) |
| B.0.1mol•L-1NaHCO3溶液与0.1NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) |
| C.CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) |
| D.含等物质的量的NaHC2O4和Na2C2O4的溶液:2c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
题号:3155089
题型:选择题
难易度:较难
日期:2016-03-25
来源:2016届福建省福州八中高三上学期第六次质检化学试卷(带解析)
【题文】人工光合作用能够借助太阳能,用CO
2和H
2O制备化学原料。科学家用氮化镓材料与铜组装如图的人工光合系统,成功地实现了以CO
2和H
2O合成CH
4,下列说法不正确的是
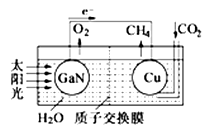
| A.该过程实质上是将太阳能转化为化学能的过程 |
| B.GaN表面发生氧化反应,有O2产生 |
| C.电解液中的H+从质子交换膜右侧向左侧迁移 |
| D.Cu表面的电极反应式CO2+8e-+8H+=CH4+2H2O |
题号:3155090
题型:选择题
难易度:较难
日期:2016-03-25
来源:2016届福建省福州八中高三上学期第六次质检化学试卷(带解析)
【题文】下列离子方程式书写正确的是
| A.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| B.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
C.以石墨作电极电解氯化铝溶液:2Cl-+2H2O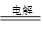 2OH-+H2↑+Cl2↑ 2OH-+H2↑+Cl2↑ |
| D.FeBr2与等物质的量的Cl2反应:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2 |
题号:3155091
题型:选择题
难易度:较难
日期:2016-03-25
来源:2016届福建省福州八中高三上学期第六次质检化学试卷(带解析)
【题文】分子式为C
10H
20O
2的酯,在一定条件下可发生如下图的转化过程:则符合上述条件的酯的结构可有
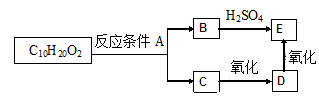
题号:3155092
题型:选择题
难易度:一般
日期:2016-03-25
来源:2016届福建省福州八中高三上学期第六次质检化学试卷(带解析)
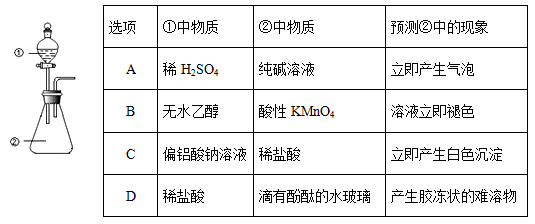
【题文】用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是
题号:3155093
题型:选择题
难易度:较难
日期:2016-03-25
来源:2016届福建省福州八中高三上学期第六次质检化学试卷(带解析)
【题文】设N
A表示阿伏加德罗常数的值,下列叙述正确的是
| A.电解精炼铜,当电路中通过的电子数为0.1NA时,阳极质量减少为3.2g |
| B.0.5L1 mol•L-1NaHS溶液中,Na+和HS-离子数之和为NA |
| C.Na2O2和Na2S的固体混合物7.8g,其中Na+数为0.3NA |
| D.3.0g甲醛和甲酸甲酯的混合物中含有的原子数为0.4NA |
题号:3155094
题型:选择题
难易度:较易
日期:2016-03-25
来源:2016届福建省福州八中高三上学期第六次质检化学试卷(带解析)
【题文】化学与生活密切相关。下列说法不正确的是
| A.用含增塑剂的聚氯乙烯薄膜作食品包装材料 |
| B.用浸泡过高锰酸钾溶液的硅藻土保鲜水果 |
| C.次氯酸钠溶液可用于环境的消毒杀菌 |
| D.中国古代用明矾溶液的酸性清洗铜镜表面的铜锈 |
题号:3155086
题型:实验题
难易度:较难
日期:2016-03-25
来源:2016届福建省福州八中高三上学期第六次质检化学试卷(带解析)
【题文】(1)工业上制取氯酸钠采用在热的石灰乳中通入氯气,然后结晶除去氯化钙后,再加入适量的
(填试剂化学式),过滤后即可得到。
(2)实验室制取氯酸钠可通过如下反应:3C1
2+6NaOH

5NaC1+NaC1O
3+3H
2O先往-5℃的NaOH溶液中通入适量C1
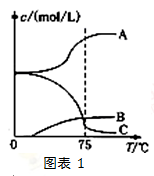
2,然后将溶液加热,溶液中主要阴离子浓度随温度的变化如右图表1所示,图中C表示的离子是
。(填离子符号)
(3)某企业采用无隔膜电解饱和食盐水法生产氯酸钠。则阳极反应式为:
。
(4)样品中C1O
3-的含量可用滴定法进行测定,步骤如下:
步骤1:准确称取样品ag(约2.20g),经溶解、定容等步骤准确配制1000mL溶液。
步骤2:从上述容量瓶中取出10.00mL溶液于锥形瓶中,准确加入25mL 1.000mol/L (NH
4)
2Fe(SO
4)
2溶液(过量),再加入75mL硫酸和磷酸配成的混酸,静置10min。
步骤3:再在锥形瓶中加入100mL蒸馏水及某种指示剂,用0.0200mol/L K
2Cr
2O
7标准溶液滴定至终点,记录消耗消耗K
2Cr
2O
7标准溶液的体积。
步骤4:为精确测定样品中C1O
3-的质量分数,重复上述步骤2、3操作2-3次。
步骤5:数据处理与计算。
①步骤2中反应的离子方程式为
;
静置10min的目的是
。
②步骤3中K
2Cr
2O
7标准溶液应盛放在
(填仪器名称)中。
③用0.0200mol/L K
2Cr
2O
7标准溶液滴定的目的是
。
④在上述操作无误的情况下,所测定的结果偏高,其可能的原因是
。
题号:4302581
题型:实验题
难易度:较难
日期:2016-03-26
来源:2016届福建省福州八中高三上学期第六次质检化学试卷(带解析)
【题文】实验室从含碘废液(除H
2O外,含有CCl
4、I
2、I
-等)中回收碘,其实验过程如下:
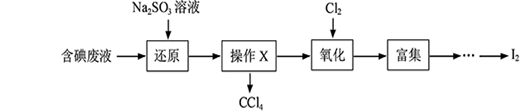
(1)向含碘废液中加入稍过量的Na
2SO
3溶液,将废液中的I
2还原为I
-,其离子方程式为
;该操作将I
2还原为I
-的目的是
。
(2)操作X的名称为
。
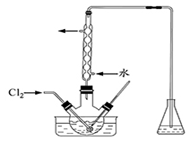
(3)氧化时,在三颈瓶中将含I
-的水溶液用盐酸调至pH约为2,缓慢通入Cl
2,在40
0C左右反应(实验装置如右图所示)。实验控制在较低温度下进行的原因是
;锥形瓶里盛放溶液作用的为
。
(4)已知:5SO
32—+2IO
3—+2H
+
I
2+5SO
42—+H
2O某含碘废水(pH约为8)中一定存在I
2,可能存在I
-、IO
3—中的一种或两种。请补充完整检验含碘废水中是否含有I
-、IO
3—的实验方案:取适量含碘废水用CCl
4多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在;证明废水中含有I
-的方法是
;证明废水中含有IO
3—的方法是
。
(实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl
3溶液、Na
2SO
3溶液)
题号:3155084
题型:填空题
难易度:较难
日期:2016-03-25
来源:2016届福建省福州八中高三上学期第六次质检化学试卷(带解析)
【题文】【化学——选修3物质结构与性质】
元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p 轨道上有4个电子。元素Z 的原子最外层电子数是其内层的3倍。
(1)X与Y所形成化合物晶体的晶胞如右图所示。
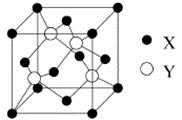
①在1个晶胞中,X离子的数目为
。
②该化合物的化学式为
。
(2)在Y的氢化物(H
2Y)分子中,Y原子轨道的杂化类型是
。
(3)Z的氢化物(H
2Z)在乙醇中的溶解度大于H
2Y,其原因是
。
(4)Y 与Z 可形成YZ
42-①YZ
42-的空间构型为
(用文字描述)。
②写出一种与YZ
42-互为等电子体的分子的化学式:
。
(5)X的氯化物与氨水反应可形成配合物[X(NH
3)
4]Cl
2,1mol该配合物中含有σ键的数目为
。
题号:3155085
题型:填空题
难易度:较难
日期:2016-03-25
来源:2016届福建省福州八中高三上学期第六次质检化学试卷(带解析)
【题文】【化学——选修2化学与技术】
Ⅰ下列有关海水综合利用的说法正确的是
| A.电解饱和食盐水可制得金属钠 | B.海带提碘只涉及物理变化 |
| C.海水提溴涉及到氧化还原反应 | D.海水提镁涉及到复分解反应 |
Ⅱ铁在自然界分别广泛,在工业、农业和国防科技中有重要应用。回答下列问题:
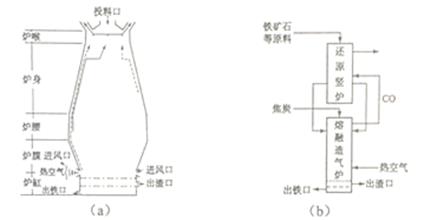
(1)用铁矿石(赤铁矿)冶炼生铁的高炉如图(a)所示。原料中除铁矿石和焦炭外含有
。除去铁矿石中脉石(主要成分为SiO
2)的化学反应方程式为
、
;高炉排出气体的主要成分有N
2、CO
2和
(填化学式)。
(2)已知:①Fe
2O
3 (s)+3C(s)="2Fe(s)+3CO(g)" ΔH=+494kJ·mol
-1②CO(g)+
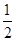
O
2(g)=CO
2(g) ΔH=-283kJ·mol
-1③C(s)+
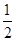
O
2(g)=CO(g) ΔH=-110kJ·mol
-1则反应Fe
2O
3 (s)+3 C(s)+
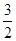
O
2(g)=2Fe(s)+3CO
2 (g) 的ΔH=
kJ·mol
-1。理论上反应
放出的热量足以供给反应
所需的热量(填上述方程式序号)
(3)有人设计出“二步熔融还原法”炼铁工艺,其流程如图(b)所示,其中,还原竖炉相当于高炉的
部分,主要反应的化学方程式为
;熔融造气炉相当于高炉的
部分。
(4)铁矿石中常含有硫,使高炉气中混有SO
2污染空气,脱SO
2的方法是
。
题号:3155087
题型:填空题
难易度:较难
日期:2016-03-25
来源:2016届福建省福州八中高三上学期第六次质检化学试卷(带解析)
【题文】研究和深度开发CO、CO
2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:Fe
2O
3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH
1=+489.0 kJ·mol
-1C(s) + CO
2(g)=2CO(g) ΔH
2 =+172.5 kJ·mol
-1则CO还原Fe
2O
3(s)的热化学方程式为
。
(2)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH
3OH(g)

HCOOCH
3(g)+2H
2(g) △H>0
第二步:HCOOCH
3(g)

CH
3OH(g)+CO(g) △H>0
①第一步反应的机理可以用下图表示:
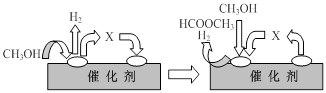
图中中间产物X的结构简式为
。
②在工业生产中,为提高CO的产率,可采取的合理措施有
。(写两条措施)
(3)第21届联合国气候变化大会(COP21)于2015年11月30日至12月11日在巴黎召开。会议旨在讨论控制温室气体CO
2的排放,减缓全球变暖,力争将全球气温上升控制在2度内。
①Li
4SiO
4可用于富集得到高浓度CO
2。原理是:在500℃,低浓度CO
2与Li
4SiO
4接触后生成两种锂盐;平衡后加热至700℃,反应逆向进行,放出高浓度CO
2,Li
4SiO
4再生。请写出700℃时反应的化学方程式为:
。
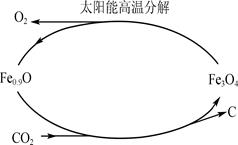
②利用太阳能和缺铁氧化物[如Fe
0.9O]可将富集到的廉价CO
2热解为碳和氧气,实现CO
2再资源化,转化过程如下图1所示,若用1mol缺铁氧化物[Fe
0.9O]与足量CO
2完全反应可生成
molC(碳)。
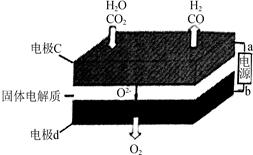
③固体氧化物电解池(SOEC)用于高温电解CO
2/H
2O,既可高效制备合成气(CO+H
2),又可实现CO
2的减排,其工作原理如图2。写出电极c上发生的电极反应式
。(任写一个)
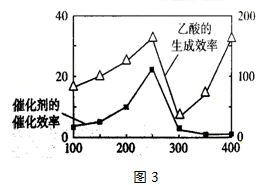
(4)以TiO
2/Cu
2Al
2O
4为催化剂,可以将CO
2和CH
4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图3。如何解释图中250-400℃时温度升高与乙酸的生成速率变化的关系
。
题号:4302582
题型:推断题
难易度:较难
日期:2016-03-26
来源:2016届福建省福州八中高三上学期第六次质检化学试卷(带解析)
【题文】【化学——选修5有机化学基础】
顺丁橡胶、制备醇酸树脂的原料M以及杀菌剂N的合成路线如下:
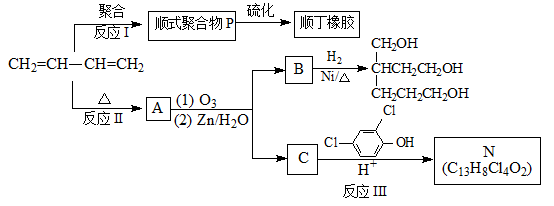
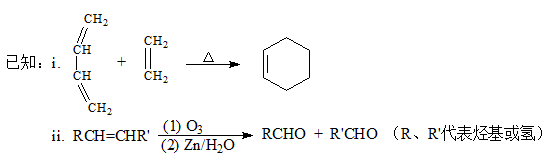
(1)CH
2=CH—CH=CH
2的名称是________________________。
(2)反应I 的反应类型是(选填字母)_______________。
a. 加聚反应 b.缩聚反应
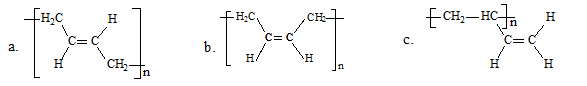
(3)顺式聚合物P的结构式是(选填字母)___________。
(4)A的相对分子质量为108。
①反应II的化学方程式是____________________。
②1 molB完全转化成M所消耗的H
2的质量是_______g。
(5)反应III的化学方程式是_________________________。
(6)A的某些同分异构体在相同的反应条件下也能生成B和C,写出其中一种同分异构体的结构简式___________________。

 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑

 5NaC1+NaC1O3+3H2O先往-5℃的NaOH溶液中通入适量C12,然后将溶液加热,溶液中主要阴离子浓度随温度的变化如右图表1所示,图中C表示的离子是 。(填离子符号)
5NaC1+NaC1O3+3H2O先往-5℃的NaOH溶液中通入适量C12,然后将溶液加热,溶液中主要阴离子浓度随温度的变化如右图表1所示,图中C表示的离子是 。(填离子符号)


 I2+5SO42—+H2O某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO3—中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO3—的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在;证明废水中含有I-的方法是 ;证明废水中含有IO3—的方法是 。
I2+5SO42—+H2O某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO3—中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO3—的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在;证明废水中含有I-的方法是 ;证明废水中含有IO3—的方法是 。

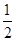 O2(g)=CO2(g) ΔH=-283kJ·mol-1
O2(g)=CO2(g) ΔH=-283kJ·mol-1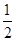 O2(g)=CO(g) ΔH=-110kJ·mol-1
O2(g)=CO(g) ΔH=-110kJ·mol-1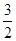 O2(g)=2Fe(s)+3CO2 (g) 的ΔH= kJ·mol-1。理论上反应 放出的热量足以供给反应 所需的热量(填上述方程式序号)
O2(g)=2Fe(s)+3CO2 (g) 的ΔH= kJ·mol-1。理论上反应 放出的热量足以供给反应 所需的热量(填上述方程式序号) HCOOCH3(g)+2H2(g) △H>0
HCOOCH3(g)+2H2(g) △H>0 CH3OH(g)+CO(g) △H>0
CH3OH(g)+CO(g) △H>0





