适用年级:{{getGradeNameByProperty('高三|月考试卷|福建|2014年')}} 试卷类型:{{getTestPaperTypeName('高三|月考试卷|福建|2014年')}} 使用省份:{{getAreaName('高三|月考试卷|福建|2014年')}}
试卷年份:{{getYear('高三|月考试卷|福建|2014年')}} 上传日期:2014-03-20 题数:20
题号:3253051
题型:选择题
难易度:一般
日期:2014-03-20
来源:2014届福建省漳州市七校高三第二次联考化学试卷(带解析)
【题文】1.92 g Cu投入到一定量的浓硝酸中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下672 ml气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的O
2 ,恰好使气体完全溶于水,则通入O
2 的体积为
A.504 ml B.336 ml C.224 ml D.168 ml
题号:3253052
题型:选择题
难易度:一般
日期:2014-03-20
来源:2014届福建省漳州市七校高三第二次联考化学试卷(带解析)
【题文】常温下,物质的量浓度为0.01 mol·L
-1 的醋酸溶液和盐酸,下列说法正确的是
A.溶液的pH相同 B.分别加入足量锌片,盐酸生成的H2 体积大 C.分别稀释100倍后,醋酸浓度与盐酸浓度相等 D.由水电离出的氢离子浓度均为1×10-12 mol·L-1
题号:3253053
题型:选择题
难易度:一般
日期:2014-03-20
来源:2014届福建省漳州市七校高三第二次联考化学试卷(带解析)
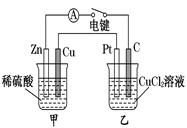
【题文】某化学兴趣小组的同学用如图所示装置研究电化学问题。当闭合该装置的电键时,观察到电流计的指针发生偏转。下列有关说法错误的是
A.甲装置是原电池,乙装置是电解池 B.当甲中产生0.1 mol气体时,乙中析出固体的质量为6.4 g C.实验一段时间后,甲烧杯中溶液的pH增大 D.将乙中的C电极换成铜电极,则乙装置可变成电镀装置
题号:3253054
题型:选择题
难易度:一般
日期:2014-03-20
来源:2014届福建省漳州市七校高三第二次联考化学试卷(带解析)
题号:3253055
题型:选择题
难易度:一般
日期:2014-03-20
来源:2014届福建省漳州市七校高三第二次联考化学试卷(带解析)
【题文】常温下,下列不发生反应的一组物质是
①铜与浓硫酸 ②二氧化硅与NaOH溶液 ③铜与浓硝酸 ④石英与纯碱
⑤铁与液氯 ⑥一氧化氮与氧气
⑦硅与氧气 ⑧H
2 S与SO
2
题号:3253057
题型:选择题
难易度:一般
日期:2014-03-20
来源:2014届福建省漳州市七校高三第二次联考化学试卷(带解析)
【题文】用N
A 代表阿伏加德罗常数的数值,下列叙述正确的是
A.在铁参与的反应中,5.6g铁完全反应失去的电子数一定为0.3NA B.1mol 12C18 O2 中,所含的中子数为22NA C.标准状况下,11.2 LCO和N2 混合气体中含有的分子数是0.5NA D.常温下,pH=12的1L氨水中含有的NH3 ·H2 O分子数是0.01 NA
题号:3253058
题型:选择题
难易度:一般
日期:2014-03-20
来源:2014届福建省漳州市七校高三第二次联考化学试卷(带解析)
【题文】
A.蒸发时,蒸发皿中固体不能蒸干才停止加热 B.蒸馏时,温度计水银球应靠近蒸馏烧瓶的支管口处 C.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 D.焰色反应时,用稀硫酸洗净铂丝,并在火焰上灼烧至无色
题号:3253059
题型:选择题
难易度:一般
日期:2014-03-20
来源:2014届福建省漳州市七校高三第二次联考化学试卷(带解析)
【题文】下列反应的离子方程式正确的是
A.NaAlO2 溶液中通入过量CO2 :2AlO2 — +CO2 +3H2 O=2Al(OH)3 ↓+CO3 2 - B.往碳酸镁中滴加稀盐酸:CO3 2- +2H+ =CO2 ↑+H2 O C.氧化铜溶于浓硝酸:CuO+2H+ =Cu2+ +2H2 O D.向Ba(OH)2 溶液中滴加NaHSO4 溶液至中性:Ba2 + +OH- +H+ +SO4 2 - =BaSO4 ↓+H2 O
题号:3253060
题型:选择题
难易度:一般
日期:2014-03-20
来源:2014届福建省漳州市七校高三第二次联考化学试卷(带解析)
题号:3253061
题型:选择题
难易度:一般
日期:2014-03-20
来源:2014届福建省漳州市七校高三第二次联考化学试卷(带解析)
【题文】下列说法中,正确的是
A.合金的熔点一般比组成合金的各成分金属高 B.我国规定商家不得无偿提供塑料袋,目的是降低成本 C.红宝石、蓝宝石和金刚石都是由碳元素组成的宝石 D.氮化硅、光导纤维、氧化铝陶瓷等属于新型无机非金属材料
题号:4316279
题型:选择题
难易度:一般
日期:2014-03-20
来源:2014届福建省漳州市七校高三第二次联考化学试卷(带解析)
【题文】下列现象或事实可用同一原理解释的是
A.浓硫酸和浓盐酸长期暴露在空气中浓度均降低 B.氯水和双氧水均要盛装在棕色试剂瓶中 C.SO2 能使品红溶液和溴水均褪色 D.NaCl固体中混有NH4 Cl或I2 ,均可用加热法除去
题号:4316280
题型:选择题
难易度:一般
日期:2014-03-20
来源:2014届福建省漳州市七校高三第二次联考化学试卷(带解析)
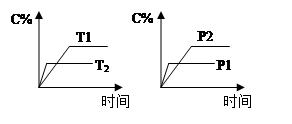
【题文】可逆反应aA(g) + bB(g)
cC(g) + dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是
A.达平衡后,若升温,平衡左移 B.达平衡后,加入催化剂则C%增大 C.化学方程式中a+b>c+d D.达平衡后,减少A的量有利于平衡向右移动
题号:4316281
题型:选择题
难易度:一般
日期:2014-03-20
来源:2014届福建省漳州市七校高三第二次联考化学试卷(带解析)
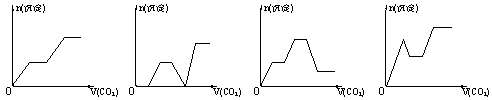
【题文】将足量的CO
2 不断通入NaOH、Ba(OH)
2 、NaAlO
2 ]的混合溶液中,生成沉淀与通入CO
2 的量的关系可表示为
A B C D
题号:4316282
题型:选择题
难易度:一般
日期:2014-03-20
来源:2014届福建省漳州市七校高三第二次联考化学试卷(带解析)
【题文】从矿物学资料查得,一定条件下自然界存在如下反应:14CuSO
4 +5FeS
2 +12H
2 O=7Cu
2 S+5FeSO
4 +12H
2 SO
4 。下列说法正确的是
A.Cu2 S既是氧化产物又是还原产物 B.5 mol FeS2 发生反应,有10 mol电子转移 C.产物中的SO4 2- 有一部分是氧化产物 D.FeS2 只作还原剂
题号:4316283
题型:选择题
难易度:一般
日期:2014-03-20
来源:2014届福建省漳州市七校高三第二次联考化学试卷(带解析)
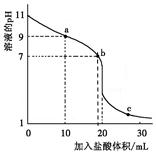
【题文】室温下,将0.100 0 mol·L
-1 盐酸滴入20.00 ml 未知浓度的某一元碱MOH溶液中,溶液pH随加入盐酸体积变化曲线如图。下列有关说法不正确的是
A.该一元碱溶液浓度为0.100 0 mol·L-1 B.a、b、c点的水溶液导电性依次增强 C.室温下,MOH的电离常数Kb =1×10-5 D.b点:c(M+ )+c(MOH)=c(Clˉ)
题号:3253048
题型:实验题
难易度:困难
日期:2014-03-20
来源:2014届福建省漳州市七校高三第二次联考化学试卷(带解析)
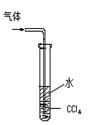
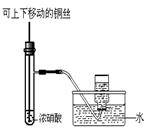
【题文】碳铵是一种较常使用的化肥,它在常温下易分解。某化学兴趣小组对碳铵的成分存在疑问,进行了如下探究。
【定性实验】检验溶液中的阴、阳离子。
取少量固体放入试管中,加入盐酸,把生成的气体通入澄清石灰水中,有白色沉淀生成。再另取少量碳铵放入试管中,加入浓NaOH溶液,加热,用湿润的红色石蕊试纸检验生成的气体,石蕊试纸变蓝色。
(1)根据实验现象,推测碳铵中所含有阴离子可能是
和
。
(2)据实验现象,碳铵与足量NaOH溶液加热反应的离子方程式可能是
。
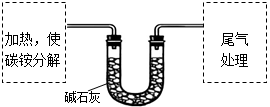
【定量实验】测定碳铵中C元素和N元素质量比。
该兴趣小组准确称取ag碳铵,加热使之分解,并把产物通入碱石灰中,如下图所示。
(1)碳铵固体应放在
中进行加热。
(2)从安全的角度考虑,尾气处理的装置可以选用
。
A B C D
(3)若灼烧后没有固体残余,称量U形管在实验前后的质量差为bg。由此测得N元素的质量是
g。
(4)为了测定碳铵中碳元素的质量,他们设计的实验方案是将ag碳铵完全溶解于水,加入过量BaCl
2 ,然后测定生成沉淀质量。请你评价该方案是否合理。
(填“合理”“不合理”),理由是
。
题号:3253049
题型:填空题
难易度:困难
日期:2014-03-20
来源:2014届福建省漳州市七校高三第二次联考化学试卷(带解析)
【题文】根据化学学科中的基本理论,请回答下列问题:
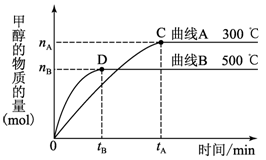
Ⅰ、常温下,取pH=2的盐酸和醋酸溶液各100 ml, 向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是_____ (填“A”或“B”)。
Ⅱ、丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。
已知:①2C
3 H
8 (g)+7O
2 (g)=6CO(g)+8H
2 O(l),△H
1 =-2741.8kJ/mol
②2CO(g)+O
2 (g)=2CO
2 (g) △H
2 =-566kJ/mol
(1)写出丙烷的燃烧热的热化学方程式:
。
(2)现有1mol C
3 H
8 在不足量的氧气里燃烧,生成1mol CO和2mol CO
2 以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:
CO(g)+H
2 O(g)=CO
2 (g)+ H
2 (g) △H
1 =+41.2kJ/mol
①下列事实能说明该反应达到平衡的是
a.体系中的压强不发生变化 b.v
正 (H
2 )=v
逆 (CO)
c.混合气体的平均相对分子质量不发生变化 d.CO
2 的浓度不再反生变化
②5min后体系达到平衡,经测定,H
2 为0.8mol,则v(H
2 )=
。
③向平衡体系中充入少量CO,则平衡常数
(填“增大”、“减小”或“不变”)。
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y
2 O
3 )的氧化锆(ZrO
2 )晶体,在其内部可以传导O
2- 。在电池内部O
2- 移向
极(填“正”或“负”);电池的正极电极反应为
。
题号:3253050
题型:填空题
难易度:较难
日期:2014-03-20
来源:2014届福建省漳州市七校高三第二次联考化学试卷(带解析)
【题文】A、B、D、E为原子序数依次增大的短周期元素。A、B组成的气体甲能使湿润的红色石蕊试纸变蓝;A、D处于同一主族,E的最外层电子数等于其电子层数。 ;四种元素的简单离子,半径最大的是 (填离子符号);单质D暴露于空气中最终产物是 。2 与水反应的化学方程式为: 。-1 乙溶液中,所含离子浓度由大到小的顺序是 。SP =1.0×10-34 ,使含0.1 mol·L-1 E离子的溶液开始产生沉淀的pH为 。
题号:3253056
题型:填空题
难易度:一般
日期:2014-03-20
来源:2014届福建省漳州市七校高三第二次联考化学试卷(带解析)
【题文】常温下,下列各组离子在指定溶液中可能大量共存的是
A.在碱性溶液中:K+ 、Cl- 、Na+ 、CO3 2- B.在c(H+ )/ c(OH- )=1×10-12 的溶液中:Ca2+ 、Cl- 、K+ 、NH4 + C.澄清透明溶液中:Cu2+ 、Fe3+ 、I- 、SO4 2- D.与铝粉反应放出氢气的无色溶液中:K+ 、NO3 - 、Cl- 、HCO3 -
题号:4316284
题型:填空题
难易度:较难
日期:2014-03-20
来源:2014届福建省漳州市七校高三第二次联考化学试卷(带解析)
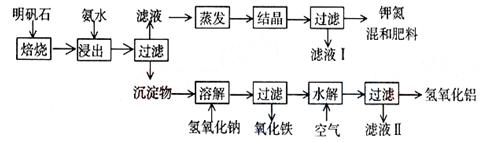
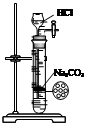
【题文】明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾[KAl(SO
4 )
2 •12H
2 O]相似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如下图所示:
根据上述图示,完成下列填空:
(1)明矾石焙烧后用稀氨水浸出。配制500ml稀氨水(每升含有39.00g氨)需要取浓氨水(每升含有250g氨)__________ml,用规格为_______ml量筒量取。
(2)氨水浸出后得到固体混合体系,过滤,滤液中除K
+ 、SO
4 2 - 外,还有大量的NH
4 + 。检验NH
4 + 的方法是_______________________________________________________。
(3)写出沉淀物中所有物质的化学式________________________________________。
(4)滤液的成分是水和______________。
(5)为测定混合肥料K
2 SO
4 、(NH
4 )
2 SO
4 中钾的含量,请完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量______溶液,产生白色沉淀。②_______、______、干燥(填实验操作名称)。③冷却、称重。
(6)若试样为mg,沉淀的物质的量为n mol,则试样中K
2 SO
4 的物质的量为:______(用含有m、n的代数式表示)。

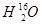 、
、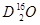 、
、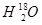 、
、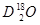 互为同素异形体
互为同素异形体 ,NH4Cl的电子式为
,NH4Cl的电子式为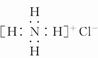
 cC(g) + dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是
cC(g) + dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是