适用年级:{{getGradeNameByProperty('高三|月考试卷|福建|2016年')}} 试卷类型:{{getTestPaperTypeName('高三|月考试卷|福建|2016年')}} 使用省份:{{getAreaName('高三|月考试卷|福建|2016年')}}
试卷年份:{{getYear('高三|月考试卷|福建|2016年')}}上传日期:2016-04-14题数:13
提示:单击题文可显示答案与解析。
题号:3146431
题型:选择题
难易度:较难
日期:2016-04-14
来源:【百强校】2016届福建省厦门一中高三下周考(三)理综化学试卷(带解析)
【题文】已知:pKa=-lgKa,25℃时,H
2SO
3的 pKa
1=1.85,pKa
2=7.19.用0.1mol•L
-1NaOH溶液滴定20mL0.1mol•L
-1H
2SO
3溶液的滴定曲线如图所示(曲线上的数字为pH).下列说法不正确的是( )
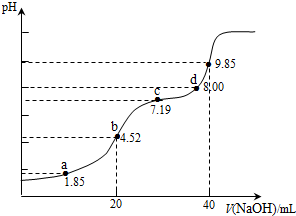
| A.a点所得溶液中:2c(H2SO3)+c(SO32-)<0.1 mol•L-1 |
| B.b点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-) |
| C.c点所得溶液中:c(Na+)<3c(HSO3−) |
| D.d点所得溶液中:c(Na+)>c(SO32-)>c(HSO3-) |
题号:3146432
题型:选择题
难易度:较难
日期:2016-04-14
来源:【百强校】2016届福建省厦门一中高三下周考(三)理综化学试卷(带解析)
【题文】根据海水综合利用的工业流程图(如图),判断下列说法正确的是
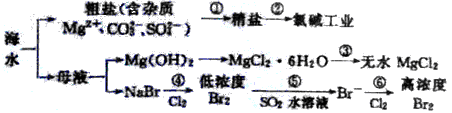
| A.过程①的提纯只有物理过程,过程②通过氧化还原反应可产生两种单质 |
| B.在过程③中将MgCl2·6H2O直接灼烧即可制得纯净无水MgCl2 |
| C.过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题 |
| D.过程⑥所得的高浓度溴水只需分液即可获得液溴 |
题号:3146433
题型:选择题
难易度:较难
日期:2016-04-14
来源:【百强校】2016届福建省厦门一中高三下周考(三)理综化学试卷(带解析)
【题文】下列有机物同分异构体数目判断错误的是( )
选项
| 有机物
| 同分异构体数目
|
A
| 分子式为C5H12
| 3
|
B
| 分子式为C5H10,能使溴的四氯化碳溶液褪色
| 5
|
C
| 分子式为C4H10O,能与Na反应生成氢气
| 4
|
D
| 分子式为C4H8O2,能与NaHCO3反应
| 3
|
题号:3146434
题型:选择题
难易度:较难
日期:2016-04-14
来源:【百强校】2016届福建省厦门一中高三下周考(三)理综化学试卷(带解析)
题号:3146435
题型:选择题
难易度:一般
日期:2016-04-14
来源:【百强校】2016届福建省厦门一中高三下周考(三)理综化学试卷(带解析)
【题文】下列各组物质中,物质之间通过一步反应就能实现图示变化的是( )
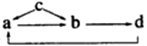
物质组编号
| a
| b
| c
| d
|
①
| NO
| NO2
| N2
| HNO3
|
②
| Na2CO3
| NaOH
| Na2O2
| NaHCO3
|
③
| FeCl3
| FeCl2
| Fe
| CuCl2
|
④
| Al2O3
| NaAlO2
| Al
| Al(OH)3
|
A.②④ B.③④ C.①②③ D.②③④
题号:3146436
题型:选择题
难易度:一般
日期:2016-04-14
来源:【百强校】2016届福建省厦门一中高三下周考(三)理综化学试卷(带解析)
【题文】下到说法正确的是(设N
A为阿伏加德罗常数)
| A.标准状况下,2.24 L SO3中硫原子与1L0.1mo1/LNa2SO3溶液中硫原子数相同 |
| B.1mo1/LFeCl3溶液全部制成胶体,其中含胶粒的数目小于NA |
| C.1molNa2O2中含有NA个阴离子 |
| D.1L0.5mo1/LNa2SO4溶液中阴离子所带电荷为NA |
题号:3146437
题型:选择题
难易度:一般
日期:2016-04-14
来源:【百强校】2016届福建省厦门一中高三下周考(三)理综化学试卷(带解析)
【题文】下列说法正确的是
| A.绿色化学的核心是应用化学原理对环境污染进行治理 |
| B.做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸,如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加 |
| C.石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化 |
| D.二氧化碳、盐酸、氨水分别属于非电解质、强电解质、弱电解质 |
题号:3146430
题型:实验题
难易度:困难
日期:2016-04-14
来源:【百强校】2016届福建省厦门一中高三下周考(三)理综化学试卷(带解析)
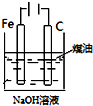
【题文】已知甲酸铜是一种重要的化工原料,常温常压下稳定,可溶于水,难溶于乙醇,具有还原性,实验室可用废铜屑(主要成份是Cu、CuO,含有少量的Fe、Fe
2O
3) 制备甲酸铜晶体[Cu(HCOO)
2·4H
2O]的流程如下:
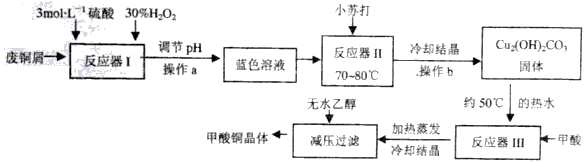
已知:

回答下列问题:
(1)反应器I中加入H
2O
2的作用是___________(用化学方程式表示)。
(2)反应器I之后溶液需调节pH的范围是___________;
(3)写出反应器II的离子方程式____________;反应器II中各反应物也可用相应物质的晶体经研磨后投入反应。则研磨时应该将固体原料放在___________(填仪器名称)中。
(4)反应器III中的反应及之后的操作应尽可能在充氮气的操作室内完成,原因是___________ 。
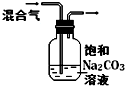
(5)甲酸铜晶体的纯度测定,实验方案:
a.准确称取mg甲酸铜晶体样品,配成250mL溶液;
b.用移液份移取25.00mL溶液于锥形瓶,加入20m11.0 mol/ LKOH溶液,充分反应后,静置数分钟。然后于锥形瓶中滴几滴酚酞试剂,用0.1000mol/ L硫酸标准溶液滴定至终点,消耗H
2SO
4标准溶液V
1mL;
c.空白实验:重复上述步骤,只是不加入甲酸铜溶液,消耗H
2SO
4标准溶液V
2mL;
①配制溶液时用到的玻璃仪器有:烧杯、量筒、玻璃棒和________;
②甲酸铜晶体的纯度________(列表达式即可)
题号:3146426
题型:填空题
难易度:较难
日期:2016-04-14
来源:【百强校】2016届福建省厦门一中高三下周考(三)理综化学试卷(带解析)
【题文】(1)硼(B)及其化合物在化学中有重要的地位,回答下列问题:
①BCl
3和NCl
3中心原子的杂化方式分别为________和________。第一电离能介于B、N之间的第2周期元素有________种。
②硼酸(H
3BO
3)是一种片层状结构的白色晶体,层内的H
3BO
3分子之间通过氢键相连,则1 molH
3BO
3的晶体中有________ mol氢键。
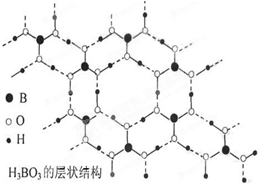
③B
3N
3H
6可用来制造具有耐油、耐高温性能的特殊材料。写出它的一种等电子体物质的分子式________。
(2)写出Fe
2+的最高能层的电子排布式________。
(3)金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)
n,该物质的中心原子价电子数与配体提供电子总数之和为18,则n= ________。
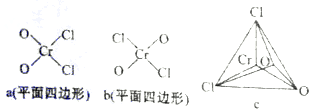
(4)常温时,氯化铬酰(CrO
2Cl
2)是易溶于CS
2、CCl
4的液体,则的分子结构最可能是________
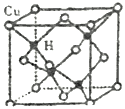
(5)铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途。CuH的晶体结构如图所示,若CuH的密度为d g/cm
3,阿伏加德罗常数的值为N
A,则该晶胞中Cu与最近距离H原子的长度为________cm。
题号:3146427
题型:填空题
难易度:困难
日期:2016-04-14
来源:【百强校】2016届福建省厦门一中高三下周考(三)理综化学试卷(带解析)
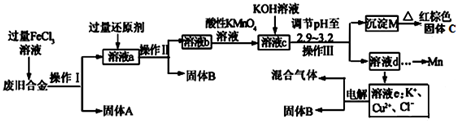
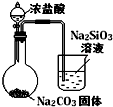
化学选修:化学与技术【题文】某研究性学习小组对某废旧合金(含有Cu、Fe、Si 三种成分)进行分离、回收.其工业流程如图:
已知:298K时,Ksp[Cu(OH)
2]=2.0×10
-20,Ksp[Fe(OH)
3]=4.0×10
-38,Ksp[Mn(OH)
2]=1.9×10
-13,
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ一定都不含有的操作是________
A.过滤 B.洗涤 C.干燥 D.蒸馏
(2)过量的还原剂应是________,溶液a中发生的反应的离子方程式为________;
(3)若用x mol/L KMnO
4溶液处理溶液b,当恰好将溶液中的阳离子完全氧化时消耗KMnO
4溶液ymL,则最后所得红棕色固体C的质量为________g(用含x、y的代数式表示).
(4)将溶液c调节pH至2.9-3.2的目的是________;
(5)常温下,取0.2mol/L的CuCl
2溶液,若要使Cu
2+开始沉淀,应调节pH至________;
(6)工业上由红棕色固体C制取相应单质常用的方法是________
A.电解法 B.热还原法 C.热分解法
(7)用惰性电极电解溶液e制取固体B,所发生的化学反应方程式为________。
题号:3146428
题型:填空题
难易度:困难
日期:2016-04-14
来源:【百强校】2016届福建省厦门一中高三下周考(三)理综化学试卷(带解析)
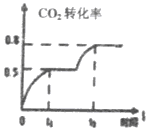
【题文】在一定条件下,CO
2可以合成一系列化工原料或燃料,在工农业生产中具有重大意义,根据以下合成过程,回答问题。
(1)目前工业上可用CO
2生产甲醇燃料,反应的化学方程式为: CO
2(g)+3H
2(g)
CH
3OH(g)+H
2O(g),△H。
已知:
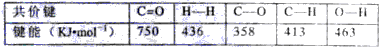
该反应△H=________KJ/mol。
(2)研究证明。用二氧化碳催化加氢来合成低碳烯烃,起始时以0.1MPa,n(H
2):n(CO
2)=3:1的投料比充入反应器中,发生反应:2CO
2(g)+6H
2(g)
C
2H
4(g)+4H
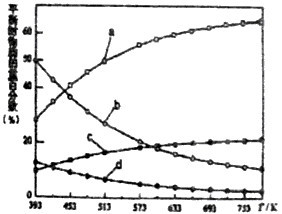
2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图所示:
①对于气体反应,用某组分(B)的平衡压强(p
B)代替物质的量浓度(c
B)也可以表示平衡常数(记作K
P),则该反应的K
P= ________;
②曲线a表示的物质为H
2,理由是________;
③为提高CO
2的平衡转化率,除改变温度外,还可采取的措施是________(列举2项).
④在强酸性电解质水溶液中,以惰性电极电解CO
2可得到多种燃料,其原理如图所示,电解时,生成乙烯的电极反应式________。
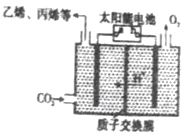
(3)工业上利用CO
2和NH
3反应来制取尿素,反应2NH
3+CO
2
CO(NH
2)
2+H
2O,在合成塔中不同氮碳比a[n(NH
3)/n(CO
2)]和水碳比b[n(H
2O)/n(CO
2)]时二氧化碳转化率(x)如图:
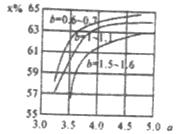
①b宜控制在________(填序号)范围内
A.0.6~0.7 B.1~1.1 C.1.5~1.61;
②a宜控制在4.0左右,理由是________。
(4) 工业上利用CO
2和CH
3OH反应制取碳酸二甲酯,反应:CO
2(g)+2CH
3OH(g)
CH
3OOCOOCH
3(g)+H
2O(g),在恒温、容积可变的密闭容器中加入1 mo1CO
2, 2molCH
3OH+CO
2的转化率与反应时间关系如图所示,在反应过程中,若t
1时容器体积为1000mL,则t
2时容器体积V=" ________" mL。
题号:3146429
题型:填空题
难易度:困难
日期:2016-04-14
来源:【百强校】2016届福建省厦门一中高三下周考(三)理综化学试卷(带解析)
【题文】电镀工业会产生大量的电镀污水处理电镀污水时会产生大量的电镀污泥,电镀污泥含有多种金属(Ni、Cu、Fe、Cr、Al)的氢氧化物和不溶性杂质。下面是处理某种电镀污泥回收铜、镍元素的一种工业流程:
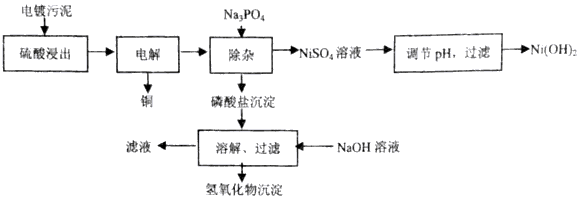
电镀污泥用硫酸浸出后得到的浸出液中各金属离子浓度见下表。

(1)硫酸浸出过程中,为提高浸出速率,可以采取的措施有___________(写出两条)。
(2)在电解回收铜的过程中,为提高下一步的除杂效果,需控制电解电压稍大一些使Fe
2+氧化,则磷酸盐沉淀中含有的物质为___________。
(3)假设电解前后Ni
2+浓度基本不变,若使Ni
2+在除杂过程不损失,则溶液中PO
43-浓度不能超过________ mol/ L。(列出计算表达式.Ksp[Ni
3(PO
4)
2]=5×10
-31)
(4)滤液中的___________可回收循环使用;研究发现当NaOH溶液浓度过大时,部分铝元素和铬元素会在滤液中出现,滤液中出现铝元素的原因为________ (用离子方程式解释)。
(5)Ni(OH)
2是镍氢蓄电池的正极材料,在碱性电解质中,电池充电时Ni(OH)
2变为NiOOH,则电池放电时正极的电极反应式为________。
(6)电镀污水中的Cr元素也可以用铁氧体法处理,原理为在废水中加入过量的FeSO
4,在酸性条件下Cr
2O
72-被还原为Cr
3+,同时生成Fe
3+;加入过量的强碱生成铁铬氧体(Cr
xFe
3-xO
4沉淀,写出加入过量强碱生成铁铬氧体(Cr
xFe
3-xO
4沉淀的离子方程式___________。
题号:3146425
题型:推断题
难易度:困难
日期:2016-04-14
来源:【百强校】2016届福建省厦门一中高三下周考(三)理综化学试卷(带解析)
化学一选修有机化学基础【题文】呋喃酚是生产农药克百威的主要中间体.其合成路线如下:
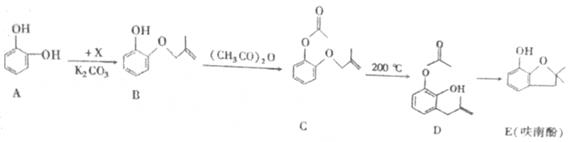
(1)A物质核磁共振氢谱中各组吸收峰的峰面积之比为________ ,B→C的反应类型是________ ,E中含氧官能团的名称是________ ,1molD最多可以消耗________ molNaOH.
(2)已知X的分子式为C
4H
7Cl,写出A→B的化学方程式:________;
(3)Y是X的同分异构体,分子中无支链且不含甲基,则Y发生消去反应所得产物的名称(系统命名)是________;
(4)下列有关化合物C、D的说法正确的是________
①可用氯化铁溶液鉴别C和D
②C和D含有的官能团完全相同
③C和D互为同分异构体
④C和D均能使溴水褪色
(5)E有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式________
①属于芳香族化合物
②苯环上的一氯代物只有一种
③含有酯基
④能发生银镜反应


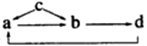






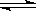 CH3OH(g)+H2O(g),△H。
CH3OH(g)+H2O(g),△H。
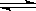 C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图所示:
C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图所示:

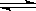 CO(NH2)2+H2O,在合成塔中不同氮碳比a[n(NH3)/n(CO2)]和水碳比b[n(H2O)/n(CO2)]时二氧化碳转化率(x)如图:
CO(NH2)2+H2O,在合成塔中不同氮碳比a[n(NH3)/n(CO2)]和水碳比b[n(H2O)/n(CO2)]时二氧化碳转化率(x)如图:
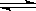 CH3OOCOOCH3(g)+H2O(g),在恒温、容积可变的密闭容器中加入1 mo1CO2, 2molCH3OH+CO2的转化率与反应时间关系如图所示,在反应过程中,若t1时容器体积为1000mL,则t2时容器体积V=" ________" mL。
CH3OOCOOCH3(g)+H2O(g),在恒温、容积可变的密闭容器中加入1 mo1CO2, 2molCH3OH+CO2的转化率与反应时间关系如图所示,在反应过程中,若t1时容器体积为1000mL,则t2时容器体积V=" ________" mL。


