适用年级:{{getGradeNameByProperty('高三|月考试卷|福建|2016年')}} 试卷类型:{{getTestPaperTypeName('高三|月考试卷|福建|2016年')}} 使用省份:{{getAreaName('高三|月考试卷|福建|2016年')}}
试卷年份:{{getYear('高三|月考试卷|福建|2016年')}}上传日期:2016-01-11题数:31
提示:单击题文可显示答案与解析。
题号:1333009
题型:选择题
难易度:一般
日期:2016-09-14
来源:【百强校】2016届福建省三明市第一中学高三上学期第二次月考化学试卷(带解析)
【题文】下列说法正确的是
| A.天然植物油常温下-般呈液态,难洛于水,有恒定的熔点、沸点 |
| B.麦芽糖与蔗糖的水解产物均含葡萄糖,故二者均为还原型二糖 |
| C.若两种二肽互为同分异构体,则二者的水解产物不一致 |
| D.乙醛、氯乙烯和乙二醇均可作为合成聚合物的单体 |
题号:3182773
题型:选择题
难易度:较难
日期:2016-01-11
来源:【百强校】2016届福建省三明市第一中学高三上学期第二次月考化学试卷(带解析)
【题文】气体的自动化检测中常常应用原电池原理的传感器。下图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号。下表列出了待测气体及敏感电极上部分反应产物。则下列说法中正确的是
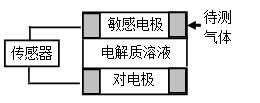
待测气体
| 部分电极反应产物
|
NO2
| NO
|
Cl2
| HCl
|
CO
| CO2
|
H2S
| H2SO4
|
A.上述气体检测时,敏感电极均作电池正极
B.检测分别含H
2S和CO体积分数相同的两份空气样本时,传感器上产生的电流大小相同
C.检测H
2S时,对电极充入空气,对电极上的电极反应式为O
2 + 2H
2O+ 4e
- = 4OH
-D.检测Cl
2时,敏感电极的电极反应式为:Cl
2 + 2e
-= 2Cl
-
题号:3182774
题型:选择题
难易度:一般
日期:2016-01-11
来源:【百强校】2016届福建省三明市第一中学高三上学期第二次月考化学试卷(带解析)
【题文】已知HCN、CN
‑在溶液中存在下列平衡及其对应的平衡常数:
①HCN

H
++CN
- △H
1>0 K
1②CN
‑+H
2O

HCN+OH
- △H
2>0 K
2常温下(K
1= 6.2×10
-10),将等体积、等物质的量浓度的HCN和NaCN溶液混合,下列叙述正确的是
| A.混合溶液的pH<7 |
| B.对混合溶液进行微热,K1增大、K2减小 |
| C.K2≈1.6×10-5 |
| D.c(Na+) =" c(HCN)" + c(CN‑) |
题号:3182775
题型:选择题
难易度:一般
日期:2016-01-11
来源:【百强校】2016届福建省三明市第一中学高三上学期第二次月考化学试卷(带解析)
【题文】硫酸锶(SrSO
4)在水中的沉淀溶解平衡曲线如图,下列说法正确的是
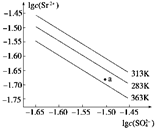
| A.283 K时,图中a点对应的溶液是不饱和溶液 |
| B.三个不同温度下,363 K时Ksp(SrSO4)最大 |
| C.温度一定时,Ksp(SrSO4)随c(SO)的增大而减小 |
| D.283 K下的SrSO4饱和溶液升温到363 K后变 |
为不饱和溶液
题号:3182776
题型:选择题
难易度:一般
日期:2016-01-11
来源:【百强校】2016届福建省三明市第一中学高三上学期第二次月考化学试卷(带解析)
【题文】利用如图所示原电池可测量空气中Cl
2含量,其中电解质是Ag
+可以自由移动的固体物质。下列分析不正确的是
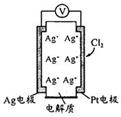
| A.电子经外电路流向Pt电极 |
| B.电池工作时,电解质中Ag+数目减少 |
| C.正极反应:Cl2+2e—+2Ag+ = 2AgCl |
| D.空气中c(Cl2)越大,Ag极消耗速率越快 |
题号:3182777
题型:选择题
难易度:容易
日期:2016-01-11
来源:【百强校】2016届福建省三明市第一中学高三上学期第二次月考化学试卷(带解析)
【题文】下表是某铬酸(H
2CrO
4)溶液中离子浓度(mol.L
-1)与pH的关系,下列说法不正确的是
pH
| c(CrO42-)
| c(HCrO4-)
| c( Cr2O72-)]
| c(H2CrO4)
|
4
| 0.0003
| 0.1040
| 0.4480
| 0
|
6
| 0.0319
| 0.0999
| 0.4370
| 0
|
7
| 0.2745
| 0.0860
| 0.3195
| 0
|
9
| 0.9960
| 0.0031
| 0.0004
| 0
|
A.铬酸的第一步电离是完全电离
B.铬酸的第二步电离是部分电离,且存在两种电离方式
C.当电离达到平衡时,2
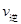
(Cr
2O
72-)=
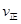
(HCrO
4-)
D.pH越大,电离出的CrO
42-浓度越大
题号:3182778
题型:选择题
难易度:一般
日期:2016-01-11
来源:【百强校】2016届福建省三明市第一中学高三上学期第二次月考化学试卷(带解析)
【题文】图示为某有机物的结构简式,1mol此有机物与足量NaOH溶液充分反应,消耗NaOH的物质的量为
题号:3182779
题型:选择题
难易度:较难
日期:2016-01-11
来源:【百强校】2016届福建省三明市第一中学高三上学期第二次月考化学试卷(带解析)
【题文】氯气溶于水达到平衡后,若只改变某一条件,下列叙述正确的是
| A.加入少量水,水的电离平衡向正方向移动 |
| B.加入少量NaHCO3固体,c(ClO-)减小 |
| C.通入少量SO2,溶液漂白性增强 |
| D.加入NaOH固体至溶液呈中性时,c(Na+) = c(Cl-)+c(ClO-)+c(HClO) |
题号:3182780
题型:选择题
难易度:较难
日期:2016-01-11
来源:【百强校】2016届福建省三明市第一中学高三上学期第二次月考化学试卷(带解析)
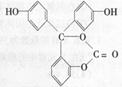
【题文】该同学用如下装置进行实验,分析影响反应速率的因素。实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1 分钟内从a管流出的水滴数,得到的水滴数如下表所示。
实验Ⅰ(断开K)1分钟水滴数
| 34
| 59
| 86
| 117
| …
| 102
|
实验Ⅱ(闭合K)1分钟水滴数
| 58
| 81
| 112
| 139
| …
| 78
|
下列说法不正确的是
A.实验Ⅰ中化学能主要转化为热能
B.实验Ⅱ中化学能主要转化为电能
C.反应前期水滴数58>34、81>59,主要原因是实验Ⅱ中形成原电池加快反应速率
D.反应后期水滴数102>78,主要原因是实验Ⅰ溶液温度高于实验Ⅱ
题号:3182781
题型:选择题
难易度:较难
日期:2016-01-11
来源:【百强校】2016届福建省三明市第一中学高三上学期第二次月考化学试卷(带解析)
【题文】室温下,将0.100 0 mol·L
-1盐酸滴入20.00 mL 未知浓度的某一元碱MOH溶液中,溶液pH随加入盐酸体积变化曲线如图所示。下列有关说法不正确的
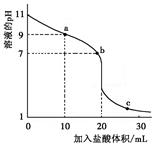
| A.该一元碱溶液浓度为0.100 0 mol·L-1 |
| B.a、b、c点的水溶液导电性依次增强 |
| C.室温下,MOH的电离常数Kb=1×10-5 |
| D.b点:c(M+)+c(MOH)=c(Clˉ) |
题号:3182782
题型:选择题
难易度:一般
日期:2016-01-11
来源:【百强校】2016届福建省三明市第一中学高三上学期第二次月考化学试卷(带解析)
【题文】一定条件下,体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g)

Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
| A.以X浓度变化表示的反应速率为0.001 mol/(L·s) |
| B.将容器体积变为20 L,Z的平衡浓度变为原来的 |
| C.其他条件不变时,若增大压强,则物质Y的转化率减小 |
| D.其他条件不变时,若升高温度,X的体积分数增大,则该反应的ΔH>0 |
题号:3182783
题型:选择题
难易度:一般
日期:2016-01-11
来源:【百强校】2016届福建省三明市第一中学高三上学期第二次月考化学试卷(带解析)
【题文】电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如右图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1∶2,以下说法正确的是
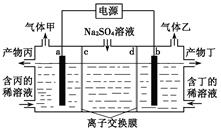
| A.a极与电源的负极相连 |
| B.产物丙为硫酸溶液 |
| C.离子交换膜d为阴离子交换膜 |
| D.a电极反应式:2H2O+2e-=H2↑+2OH- |
题号:3182784
题型:选择题
难易度:较难
日期:2016-01-11
来源:【百强校】2016届福建省三明市第一中学高三上学期第二次月考化学试卷(带解析)
【题文】一定条件下,Cu
2+、Mn
2+、Fe
3+的浓度对乙酸在光照下催化降解速率的影响如图所示。下列判断不正确的是
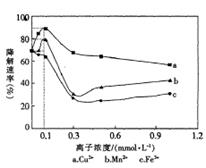
| A.该实验方案的缺陷之一是未做空白对照实验 |
| B.Cu2+、Mn2+提高乙酸降解速率的最佳浓度为0.1 mmol·L-l |
| C.Fe3+不能提高乙酸降解速率 |
| D.相同条件下,乙酸在Cu2+、Mn2+、Fe3+作用下的降解速率依次减小 |
题号:3182785
题型:选择题
难易度:一般
日期:2016-01-11
来源:【百强校】2016届福建省三明市第一中学高三上学期第二次月考化学试卷(带解析)
【题文】下列除杂质的方法不正确的是
| A.氢氧化铁胶体中的铁离子和氯离子可用渗析法除去 |
| B.氯化钠中有少量氯化铵,加过量的烧碱溶液后加热蒸干 |
| C.乙酸乙酯中混有少量乙酸,用饱和碳酸钠溶液洗涤后分液 |
| D.硬脂酸甘油酯中混有少量的甘油,用盐析法除去 |
题号:3182786
题型:选择题
难易度:一般
日期:2016-01-11
来源:【百强校】2016届福建省三明市第一中学高三上学期第二次月考化学试卷(带解析)
【题文】在一定温度下,容积一定的密闭容器中发生反应A(s)+2B(g)

C(g)+D(g),当下列物理量不再发生变化时,表明反应已达平衡的是
①混合气体的密度②混合气体的压强③B的物质的量浓度④混合气体的总物质的量
题号:3182787
题型:选择题
难易度:一般
日期:2016-01-11
来源:【百强校】2016届福建省三明市第一中学高三上学期第二次月考化学试卷(带解析)
【题文】现有常温下的四种溶液(如下表),下列有关叙述中正确的是
| ①
| ②
| ③
| ④
|
溶液
| 氨水
| 氢氧化钠溶液
| 醋酸
| 盐酸
|
pH
| 11
| 11
| 3
| 3
|
A.V
1L④与V
2L②溶液混合后,若混合后溶液pH=4,则V
1:V
2=9:11
B.在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变
C.分别加水稀释10倍、四种溶液的pH:①>②>③>④
D.将①、④两种溶液等体积混合,所得溶液中:c (NH
4+)>c(Cl
-)>c(OH
-)>c(H
+)
题号:3182788
题型:选择题
难易度:一般
日期:2016-01-11
来源:【百强校】2016届福建省三明市第一中学高三上学期第二次月考化学试卷(带解析)
【题文】已知25 ℃时,BaCO
3的溶度积K
sp=2.58×10
-9,BaSO
4的溶度积K
sp=1.07×10
-10,则下列说法不正确的是
| A.25 ℃时,当溶液中c(Ba2+)·c(SO42-)=1.07×10-10时,此溶液为BaSO4的饱和溶液 |
| B.25 ℃时,在含有BaCO3固体的饱和溶液中滴入少量Na2SO4溶液后有BaSO4沉淀析出,此时溶液中c(CO)∶c(SO)≈24.11 |
| C.因为Ksp(BaCO3)>Ksp(BaSO4),所以无法将BaSO4转化为BaCO3 |
| D.在饱和BaCO3溶液中加入少量Na2CO3固体,可使c(Ba2+)减小,BaCO3的溶度积不变 |
题号:3182789
题型:选择题
难易度:较难
日期:2016-01-11
来源:【百强校】2016届福建省三明市第一中学高三上学期第二次月考化学试卷(带解析)
【题文】利用合成气(主要成分为 CO、CO
2和 H
2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H
2(g)

CH
3OH(g) △H
1=-99kJ·mol
-1②CO
2(g)+3H
2(g)

CH
3OH(g)+H
2O(g) △H
2③CO
2(g)+H
2(g)

CO(g)+H
2O(g) △H
3=+41kJ·mol
-1已知反应①中的相关的化学键键能数据如下,则 C-H 键能和△H
2分别是
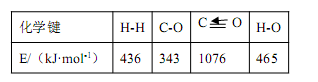
| A.403 kJ·mol-1,-66 kJ·mol-1 | B.423 kJ·mol-1,+28 kJ·mol-1 |
| C.413 kJ·mol-1,-58 kJ·mol-1 | D.314 kJ·mol-1,-18 kJ·mol-1 |
题号:3182791
题型:选择题
难易度:一般
日期:2016-01-11
来源:【百强校】2016届福建省三明市第一中学高三上学期第二次月考化学试卷(带解析)
【题文】某有机物有如下性质:①能和银氨溶液共热得到银镜;②加入碳酸氢钠无变化;③与含酚酞的氢氧化钠溶液共热,发现红色褪去。则该有机物可能是
题号:3182792
题型:选择题
难易度:较易
日期:2016-01-11
来源:【百强校】2016届福建省三明市第一中学高三上学期第二次月考化学试卷(带解析)
【题文】下列事实说明HNO
2为弱电解质的是
①0.1 mol·L
-l HNO
2溶液的pH=2.1; ②常温下NaNO
2溶液的pH>7 ; ③用HNO
2溶液做导电实验时,灯泡很暗;④HNO
2溶液和KCl溶液不发生反应 ⑤HNO
2能与碳酸钠反应制CO
2;⑥HNO
2不稳定,易分解
题号:3182793
题型:选择题
难易度:一般
日期:2016-01-11
来源:【百强校】2016届福建省三明市第一中学高三上学期第二次月考化学试卷(带解析)
【题文】某温度下,将2 mol A和1 mol B放入一密闭容器中,发生反应:A(g)+B(g)

2C(s)+2D(g),5 min后反应达到平衡,测得生成C为0.8 mol,下列相关表述正确的是
A.该反应的化学平衡常数表达式是K=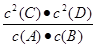 |
| B.该条件下B的平衡转化率是40% |
| C.增大该体系的压强,A的转化率增大 |
| D.若向平衡体系中加入少量生成物C,则正、逆反应速率均增大 |
题号:3182794
题型:选择题
难易度:一般
日期:2016-01-11
来源:【百强校】2016届福建省三明市第一中学高三上学期第二次月考化学试卷(带解析)
【题文】下列方程式不能正确解释实验事实的是
| A.铁溶于稀硝酸,溶液变黄:3Fe +8H+ +2NO3-=3Fe2++2NO↑+4H2O |
B.Na2CO3溶液能使酚酞试液变红:CO32- +H2O HCO3-+OH- HCO3-+OH- |
C.0.l mol·L-l CH3COOH溶液的pH >1: CH3COOH CH3COO-+H+ CH3COO-+H+ |
| D.向Mg(OH)2悬浊液中加入FeCl3溶液,出现红褐色沉淀: |
3Mg(OH)
2(s)+2Fe
3+(aq)=2Fe( OH)
3(s)+3Mg
2+(aq)
题号:3182795
题型:选择题
难易度:容易
日期:2016-01-11
来源:【百强校】2016届福建省三明市第一中学高三上学期第二次月考化学试卷(带解析)
【题文】下列物质在生活中应用时,起氧化作用的是
| A.明矾作净水剂 |
| B.漂粉精作消毒剂 |
| C.甘油作护肤保湿剂 |
| D.铁粉作食品袋内的脱氧剂 |
题号:3182796
题型:选择题
难易度:容易
日期:2016-01-11
来源:【百强校】2016届福建省三明市第一中学高三上学期第二次月考化学试卷(带解析)
【题文】下列说法不正确的是
| A.医用酒精的浓度通常为75% |
| B.用灼烧并闻气味的方法区别纯棉织物和纯毛织物 |
| C.采集某雨水样品,放置一段时间,pH由4.8变为4.2,是因为水中溶解了较多的CO2 |
| D.氢氧化铝和碳酸氢钠都可以作为治疗胃酸过多的药剂 |
题号:4303796
题型:选择题
难易度:一般
日期:2016-01-11
来源:【百强校】2016届福建省三明市第一中学高三上学期第二次月考化学试卷(带解析)
【题文】用右图所示装置除去含CN
-、Cl
-废水中的CN
-时,控制溶液PH为9~10,阳极产生的ClO
-将CN
-氧化为两种无污染的气体,下列说法不正确的是( )
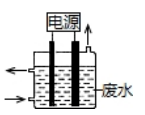
| A.用石墨作阳极,铁作阴极 |
| B.阳极的电极反应式为:Cl- + 2OH--2e-= ClO- + H2O |
| C.阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH- |
| D.除去CN-的反应:2CN-+ 5ClO- + 2H+ = N2↑ + 2CO2↑ + 5Cl-+ H2O |
题号:3182767
题型:填空题
难易度:较难
日期:2016-01-11
来源:【百强校】2016届福建省三明市第一中学高三上学期第二次月考化学试卷(带解析)
【题文】(1)硼酸(H
3BO
3)溶液中存在如下反应:
H
3BO
3(aq)+H
2O(l)

[B(OH)
4]
-(aq)+H
+(aq)。已知25℃时它的电离常数K=5.7×10
-10。则此温度下0.7 mol·L
-1硼酸溶液中H
+的浓度=
。(计算结果保留小数点后一位)
(2)常温下,0.1 mol·L
-1的氯化铵溶液pH=5.1.若常温下氨水的电离常数K
b=10
-X,则x=
。
题号:3182768
题型:填空题
难易度:较难
日期:2016-01-11
来源:【百强校】2016届福建省三明市第一中学高三上学期第二次月考化学试卷(带解析)
【题文】已知多元弱酸在水溶液中的电离是分步进行的,且第一步电离的程度远大于第二步电离的程度,第二步电离的程度远大于第三步电离的程度……
今有HA、H2B、H3C三种弱酸,根据“较强酸+较弱酸盐→较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应:①HA+HC2-(少量)=A-+H2C-;②H2B(少量)+2A-=B2-+2HA;③H2B(少量)+H2C-=HB-+H3C。回答下列问题:
(1)相同条件下,HA、H2B、H3C三种酸中酸性最强的是________。
(2)A-、B2-、C3-、HB-、H2C-、HC2-六种离子中最易结合质子的是__________,最难结合质子的是___________。
(3)下列离子方程式中正确的是________。
A.H3C+3A-=3HA+C3-
B.HB-+A-=HA+B2-
C.H3C+B2-=HB-+H2C-
(4)完成下列反应的离子方程式:
H3C+OH-(过量)→_________;
HA(过量)+C3-→__________。
题号:3182769
题型:填空题
难易度:一般
日期:2016-01-11
来源:【百强校】2016届福建省三明市第一中学高三上学期第二次月考化学试卷(带解析)
【题文】黄铁矿石的主要成分为FeS
2和少量FeS(假设其他杂质中不含Fe、S元素,且高温下不发生化学变化),是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。
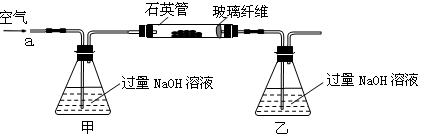
将m
1 g该黄铁矿石的样品放入如图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。其反应的化学方程式为:4FeS
2+11O
2
2Fe
2O
3+8SO
2,4FeS + 7O
2
2Fe
2O
3+4SO
2【实验一】:测定硫元素的含量
反应结束后,将乙瓶中的溶液进行如下处理:
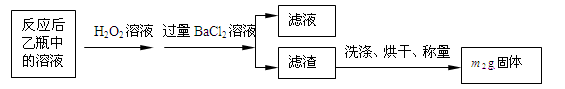
(1)鼓入空气的作用是________________________________________________________。
(2)反应结束后乙瓶中的溶液需加足量H
2O
2溶液的目的是(用化学方程式表示)_________________________________________________________。H
2O
2可以看作是一种很弱的酸,写出其电离方程式:
。
(3)该黄铁矿石中硫元素的质量分数为
(列出表达式即可)。
【实验二】:测定铁元素的含量
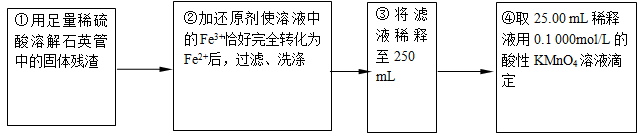
(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量____________(填“偏大”、“偏小”或“无影响”)。
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有_________________。
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
实验次数
| 第一次
| 第二次
| 第三次
| 第四次
|
消耗KMnO4溶液体积/mL
| 25.00
| 25.03
| 20.00
| 24.97
|
根据所给数据,计算该稀释液中Fe
2+的物质的量浓度为c(Fe
2+) =_______________。
题号:3182770
题型:填空题
难易度:较易
日期:2016-01-11
来源:【百强校】2016届福建省三明市第一中学高三上学期第二次月考化学试卷(带解析)
【题文】以含钴废催化剂(主要成分为Co、Fe、SiO
2)为原料,制取钴的氧化物的流程如下:
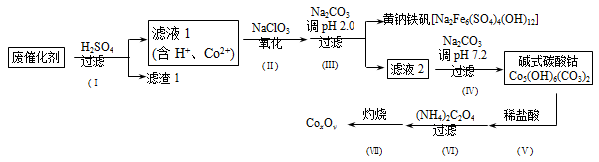
(1)步骤Ⅰ中废催化剂用硫酸浸出后,将滤渣1进行再次浸出,其目的是____________。
(2)步骤Ⅱ需要加热搅拌,相应的离子方程式为_____________________。
(3)步骤Ⅲ中的反应为2Na
++6Fe
3++4SO
42-+12H
2O=Na
2Fe
6(SO
4)
4(OH)
12+12H
+。过滤后母液的pH = 2.0,c(Na
+) ="a" mol·L
-1,c(Fe
3+) ="b" mol·L
-1,c(SO
42-)=" d" mol·L
-1,该反应的平衡常数K=___(用含a 、b 、d 的代数式表示)。
(4)完成步骤Ⅳ中反应的离子方程式:
□_______+□CO
32-+□H
2O=Co
5(OH)
6(CO
3)
2↓+□_____
(5)已知CoCl
2的溶解度曲线如图所示。步骤Ⅴ向碱式碳酸钴中加入足量稀盐酸,边加热边搅拌,待固体溶解后需趁热过滤。
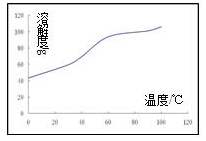
①边加热边搅拌的原因是______________;
②趁热过滤的原因是______________。
题号:3182771
题型:填空题
难易度:较难
日期:2016-01-11
来源:【百强校】2016届福建省三明市第一中学高三上学期第二次月考化学试卷(带解析)
【题文】氢气是一种理想的“绿色能源”,下图为氢能产生与利用的途径
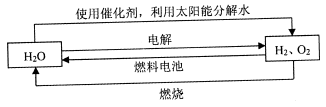
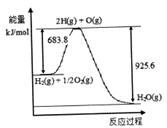
(1)上图中4个过程中能量转化形式有_____________。
(2)电解过程要消耗大量电能,而使用微生物作催化剂在阳光下即可分解

以上反应的△H
1_____________△H
2 (选填“>"、“<”或“=”)。
(3)已知H
2 O(1)→H
2 O(g)△H=" +44" mol·L
-1,依据右图能量变化写出氢气燃烧生成液态水的热化学方程式________________________________。
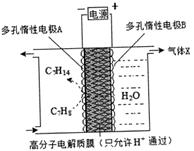
(4)氢能利用需要选择合适的储氢材料
①镧镍合金在一定条件下可吸收氢气形成氢化物:LaNi
5(s)+3H
2(g)

LaNi
5H
6(s) △H<0,欲使LaNi
5H
6 (s)释放出气态氢,根据平衡移动原理,可改变的条件之一是___________。
②一定条件下,如图所示装置可实现有机物的电化学储氢,总反应:2C
7 H
8+6 H
2O(1)

2C
7 H
14+3O
2 (g) 电解过程中产生的气体X为_________,电极A发生的电极反应式为____________。
题号:3182772
题型:填空题
难易度:较难
日期:2016-01-11
来源:【百强校】2016届福建省三明市第一中学高三上学期第二次月考化学试卷(带解析)
【题文】(1) 一定温度下,向1 L 0.l mol·L
-1 CH
3 COOH溶液中加入0.1 molCH
3COONa固体,溶液中
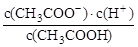
(填“增大”、“减小”或“不变”)。
(2)常温下,将VmL、0.1000mol·L
-1氢氧化钠溶液逐滴加入到20.00mL、0.1000mol·L
-1醋酸溶液中,充分反应。回答下列问题。
①如果溶液pH=7,此时V的取值__
___20.00(填“>”、“<”或“=”),而溶液中 c(Na
+)、c(CH
3COO
-)、c(H
+)、c(OH
-)的大小关系为_____________________________。
②如果V=40.00,则此时溶液中c(OH
-) -c(H
+) - c(CH
3COOH)= _________mol·L
-1。
(3)常温下,向20 ml 0.1mol·L
-1 Na
2CO
3溶液中逐滴加入0.1mol·L
-1 HC1溶液40 mL,溶液中含碳元素的各种微粒(CO
2因逸出未画出)物质的量分数随溶液pH变化的情况如下图,回答下列问题:
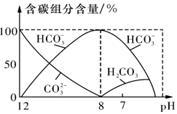
①若将Na
2CO
3和NaHCO
3混合物配成溶液,
则此溶液的pH的取值范围是
;
②为测定Na
2CO
3和NaHCO
3混合物中的质量分 数,下列方案可行的是
。
| A.取a克混合物充分加热,减重b克 |
| B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体 |
| C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克 |
| D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体 |

 H++CN- △H1>0 K1
H++CN- △H1>0 K1 HCN+OH- △H 2>0 K2
HCN+OH- △H 2>0 K2

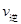 (Cr2O72-)=
(Cr2O72-)=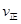 (HCrO4-)
(HCrO4-)


 Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是

 C(g)+D(g),当下列物理量不再发生变化时,表明反应已达平衡的是
C(g)+D(g),当下列物理量不再发生变化时,表明反应已达平衡的是 CH3OH(g) △H1=-99kJ·mol-1
CH3OH(g) △H1=-99kJ·mol-1 CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2 CO(g)+H2O(g) △H3=+41kJ·mol-1
CO(g)+H2O(g) △H3=+41kJ·mol-1
 2C(s)+2D(g),5 min后反应达到平衡,测得生成C为0.8 mol,下列相关表述正确的是
2C(s)+2D(g),5 min后反应达到平衡,测得生成C为0.8 mol,下列相关表述正确的是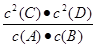
 HCO3-+OH-
HCO3-+OH- CH3COO-+H+
CH3COO-+H+
 [B(OH)4]-(aq)+H+(aq)。已知25℃时它的电离常数K=5.7×10-10。则此温度下0.7 mol·L-1硼酸溶液中H+的浓度= 。(计算结果保留小数点后一位)
[B(OH)4]-(aq)+H+(aq)。已知25℃时它的电离常数K=5.7×10-10。则此温度下0.7 mol·L-1硼酸溶液中H+的浓度= 。(计算结果保留小数点后一位)
 2Fe2O3+8SO2,4FeS + 7O2
2Fe2O3+8SO2,4FeS + 7O2 2Fe2O3+4SO2
2Fe2O3+4SO2






 LaNi5H6(s) △H<0,欲使LaNi5H6 (s)释放出气态氢,根据平衡移动原理,可改变的条件之一是___________。
LaNi5H6(s) △H<0,欲使LaNi5H6 (s)释放出气态氢,根据平衡移动原理,可改变的条件之一是___________。 2C7 H14+3O2 (g) 电解过程中产生的气体X为_________,电极A发生的电极反应式为____________。
2C7 H14+3O2 (g) 电解过程中产生的气体X为_________,电极A发生的电极反应式为____________。
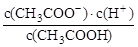 (填“增大”、“减小”或“不变”)。
(填“增大”、“减小”或“不变”)。