适用年级:{{getGradeNameByProperty('高三|月考试卷|福建|2015年')}} 试卷类型:{{getTestPaperTypeName('高三|月考试卷|福建|2015年')}} 使用省份:{{getAreaName('高三|月考试卷|福建|2015年')}}
试卷年份:{{getYear('高三|月考试卷|福建|2015年')}}上传日期:2015-07-03题数:12
提示:单击题文可显示答案与解析。
题号:3203748
题型:选择题
难易度:较难
日期:2015-07-03
来源:2015届福建省南平市高三5月质检理综化学试卷(带解析)
【题文】三种常见的酸(或碱)在水溶液中的电离情况如下表,下列说法正确的是

| A.温度相同,物质的量浓度也相同的MA和MB溶液,前者pH大于后者 |
B.pH相同的HA和HB的溶液中 |
| C.相同浓度的MOH溶液,溶液的碱性随温度的升高而减弱 |
| D.25℃时MOH抑制水的电离,100℃时MOH促进水的电离 |
题号:3203749
题型:选择题
难易度:较难
日期:2015-07-03
来源:2015届福建省南平市高三5月质检理综化学试卷(带解析)
【题文】某化学反应:A(g)
B(g)+C(g),在温度为3 00K时,向2.0L恒容密闭容器中充入1.0mol A,反应过程中测得的B物质的物质的量随时间的变化关系如图,下列说法不正确的是

A.0~50秒,A物质化学反应速率v(A)=0.0016mo1·L
-1·S
-1B.250s时该反应达到化学平衡状态
C.若改加入2.0mol A,A的平衡转化率大于20%
D.300K时,该反应的平衡常数为0.025 mol·L
-1
题号:3203750
题型:选择题
难易度:一般
日期:2015-07-03
来源:2015届福建省南平市高三5月质检理综化学试卷(带解析)
【题文】设N
A为阿伏加德罗常数的值,下列说法不正确的是
| A.4.6克钠与水反应时失去的电子数目为0.2NA |
| B.1 L0.5mol·L-1 Na2SO4溶液中所含有的Na+离子数日为NA |
| C.在标准状况下,22.4LNH3所含的氨分子数目为NA |
| D.常温常压下2克氢气所含原子数目为NA |
题号:3203751
题型:选择题
难易度:较难
日期:2015-07-03
来源:2015届福建省南平市高三5月质检理综化学试卷(带解析)
【题文】A、B、C、x均为中学化学常见物质,且A、B、C含有同一种元素,在一定条件下发生如图所示的化学变化。则x不可能是

A.Al B.C C.O
2 D.Fe
题号:3203752
题型:选择题
难易度:较难
日期:2015-07-03
来源:2015届福建省南平市高三5月质检理综化学试卷(带解析)
【题文】工业上电解法制铝原理如图。下列说法正确的是

| A.电解过程中每转移12 mol电子,会产生2 molO2 |
| B.加入助熔剂冰晶石(Na3AIF6)可降低电解的温度 |
| C.电解过程中阳极反应式4A13++12e-→4Al |
| D.若用该装置电解氯化铝溶液也能得到金属铝 |
题号:3203753
题型:选择题
难易度:一般
日期:2015-07-03
来源:2015届福建省南平市高三5月质检理综化学试卷(带解析)
【题文】下图是元素周期表的一部分,Y原子最外层电子数是次外层电子数的3倍,下列说法正确的是

| A.简单氢化物稳定性:X>Z |
| B.简单离子半径: Y<M |
| C.最高价氧化物水化物的酸性:X<Z |
| D.得电子能力:X>Y |
题号:3203754
题型:选择题
难易度:一般
日期:2015-07-03
来源:2015届福建省南平市高三5月质检理综化学试卷(带解析)
【题文】下列说法正确的是
| A.CH2==CH2和CH3CH2C1都属于烃 | B.乙烯和乙烷都能发生加聚反应 |
| C.米酒变酸的过程涉及氧化反应 | D.未成熟的苹果遇碘水不会变蓝 |
题号:3203745
题型:实验题
难易度:困难
日期:2015-07-03
来源:2015届福建省南平市高三5月质检理综化学试卷(带解析)
【题文】(15分)某研究小组为了探究SO
2的实验室制法和有关化学性质,设计了如下的实验。
实验I:

(1)实验基本操作分析:
①多孔隔板与活塞相配合,能起到的作用是_____________________________________.
②该实验制H
2时需用浓硫酸配制480mL 3 mol/L的稀硫酸,配制中所需的玻璃仪器有250 mL烧杯、l 00mL量筒、玻璃棒、胶头滴管等,还需_______________________.
③该实验过程中H
2所起的作用是_____________________________.
(2)实验时先打开活塞,让装置A内试剂反应一段时间后,关闭活塞,再往装置B中滴入适量浓硫酸反应片刻后,甲、乙两学生分别取装置D中少量溶液,甲学生往其中加入酸性KMnO
4溶液,观察到酸性KMn O
4溶液紫红色褪去;乙学生往其中加入盐酸酸化的BaCl
2溶液,观察到有白色沉淀生成。根据各自实验现象甲、乙学生得出SO
2被Fe
3+氧化。
①试判断甲、乙学生的结论是否严谨________________(填写选项)。
A.甲学生严谨 B.乙学生严谨 C.甲、乙学生都不严谨
②写出SO
2被Fe
3+氧化的离子反应方程式_____________________________________.
实验II:
(3)该研究小组为测定SO
2催化氧化为SO
3的转化率,又设计了如下实验:已知SO
3熔点为16.8℃,且忽略空气中CO
2的影响).

①当停止通入SO
2,熄灭酒精灯后,需要继续通入氧气,其目的是:____________________.
②实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是_______________(用含字母的代数式表示,不用化简)。
题号:3203746
题型:实验题
难易度:困难
日期:2015-07-03
来源:2015届福建省南平市高三5月质检理综化学试卷(带解析)
【题文】(15分)某工业废料钡泥中主要含有BaCO
3、BaSO
3、Ba(FeO
2)
2等,某实验小组模拟工业过程利用钡泥制取BaCO
3和Ba(NO
3)
2晶体(不含结晶水),其实验流程如下:

已知:
①Fe
3+和Fe
2+以氢氧化物形式沉淀完全时,溶液的pH分虽为3.2和9.7;
②Ba(NO
3)
2晶体的分解温度:592℃; Ba(NO
3)
2的溶解度在高温时较大,低温时较小;
③
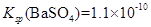
,

.
(1)酸溶时,BaCO
3发生反应的离子反应方程式为___________________________________
(2)酸溶后,滤液1除了Ba
2+外,还存在的阳离子是____________________等(填写离子符号)。
(3)加入X的目的是_______________________________________________。
(4)若在操作II中加入Na
2CO
3来制取BaCO
3,经检验所得BaCO
3中含有少量BaSO
4而不纯,提纯的方法是:将产品加入足量的饱和Na
2CO
3溶液中,充分搅拌和静置后,弃去上层清液。如此反复多次处理,直到BaSO
4全部转化为BaCO
3,该提纯原理的离子反应方程式是_______________________________________
(5)若用(4)的方法处理含有0.21mol BaSO
4样品,每次用1.0 L 2.0mol·L
-1饱和Na
2CO
3溶液,则至少需要处理________次,BaSO
4才能全部转化BaCO
3。
(6)操作III的名称是:________、冷却结晶、_________、洗涤、干燥。
(7)上述流程中对环境的影响主要有_________。因此要进一步处理,避免造成二次污染。
题号:3203743
题型:填空题
难易度:较难
日期:2015-07-03
来源:2015届福建省南平市高三5月质检理综化学试卷(带解析)
【题文】[化学一有机化学基础](13分)对羟基扁桃酸是合成香料的重要中间体,它可由如下反应合成:
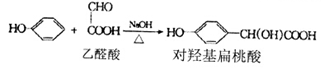
已知:
没有
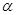
—氢的醛与强碱共热时,该醛一分子被氧化成酸,另一分子被还原成醇的反应称为康尼查罗(Cnanizzoar)反应。如:2HCHO+NaOH
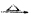
CH
3OH+HCOONa
(1)对羟基扁桃酸的分子式______________,乙醛酸分子中一种含氧官能团的名称________。
(2)写出一种满足下列三个条件的对羟基扁桃酸的同分异构体结构简式________________。
a.属于甲酸酯 b.含酚羟基 c.含亚甲基(一CH
2一)
(3)苯酚能与甲醛发生聚合反应生成酚醛树脂,写出酚醛树脂的结构简式________________。
(4)对羟基扁桃酸不能发生的反应类型有_____________________________(填选项)。
(5)写出乙醛酸发生康尼查罗反应的化学方程式_____________________________________.
题号:3203744
题型:填空题
难易度:较难
日期:2015-07-03
来源:2015届福建省南平市高三5月质检理综化学试卷(带解析)
【题文】[化学一物质结构与性质](13分)钛被称为“国防金属’’和“生物金属”,是重要的结构材料。
(1)基态钛原子的核外电子排布式是_______________________________,钛所在的周期中第一电离能最小的元素是______________________________.
(2)金红石(TiO
2)的熔点

,用熔盐法直接电解金红石可获得金属钛,金红石所属的晶体类型是______________________________________晶体。
(3)TiCl
4能与NH
4CI反应生成配合物(NH
4)
2[TiCl
6]。此配合物中,形成配位键时提供孤对电子的有_____________.(填元素符号),空间构型呈正四面体的微粒是___________。
(4)TiO
2+与H
2O
2在稀酸中反应生成橘红色的[TiO(H
2O
2) ]
2+离子,可用于钛的定性检验。
[TiO(H
2O
2) ]
2+中不含有_____________________________.
A.极性键
B.非极性键
C.

键
D.

键
E.离子键
(5)H
2O
2分子可看成H
2O分子中的一个H被OH所取代,下列关于H
2O
2的说法正确的是______
A.H
2O
2分子结构对称为非极性分子
B.I mol H
2O
2最多能形成2mol氢键
C.H
2O
2不稳定是因为氢键的键能较小
D.H
2O
2分子的空间构型为直线形
题号:3203747
题型:填空题
难易度:困难
日期:2015-07-03
来源:2015届福建省南平市高三5月质检理综化学试卷(带解析)
【题文】(15分)卤素的单质及其化合物在生产、生活中应用广泛。
(1)“碘盐"通常是在食盐中添加适量的K1O
3,为缺碘地区人们提供碘元素。
①碘元素的一种原子含74个中子、5 3个质子,表示此核素的符号是___(如

)。
②“碘盐"溶液用稀硫酸酸化后,再加入淀粉碘化钾溶液,溶液由无色变篮色。
写出该反应的化学方程式__________________________________________。
③碘单质溶解在有机溶剂___________中形成常用的医用消毒剂(填结构简式)。
(2)工业上利用氢气和氯气反应制取盐酸,设计成原电池又能获取电能,下列说法错误的是___(填选项)。
| A.两极材料可用石墨,用稀盐酸做电解质溶液 |
B.通氯气的电极反应式为 |
| C.电解质溶液中的阳离子向通氯气的电极移动‘ |
| D.通入氢气的电极为原电池的正极 |
(3)H
2和卤素单质(F
2、C1
2、Br
2、1
2)反应生成I molHX的能量变化如图所示(反应物和产物均为298K时的稳定状态)。

①曲线A代表的卤化氢是__________(填化学式)。
②写出Br
2(1)与HCI气体反应的热化学方程式___________。
③往甲乙两容器分别通入等量的H
2和I
2,两容器起始状态相同,甲为恒容绝热密闭容器,乙为恒容恒温密闭容器,发生反应

,反应达到平衡后,H
2的体积分数甲_______乙(填“>’’‘‘=”或“<”)。


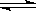 B(g)+C(g),在温度为3 00K时,向2.0L恒容密闭容器中充入1.0mol A,反应过程中测得的B物质的物质的量随时间的变化关系如图,下列说法不正确的是
B(g)+C(g),在温度为3 00K时,向2.0L恒容密闭容器中充入1.0mol A,反应过程中测得的B物质的物质的量随时间的变化关系如图,下列说法不正确的是






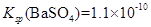 ,
,  .
.
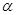 —氢的醛与强碱共热时,该醛一分子被氧化成酸,另一分子被还原成醇的反应称为康尼查罗(Cnanizzoar)反应。如:2HCHO+NaOH
—氢的醛与强碱共热时,该醛一分子被氧化成酸,另一分子被还原成醇的反应称为康尼查罗(Cnanizzoar)反应。如:2HCHO+NaOH 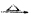 CH3OH+HCOONa
CH3OH+HCOONa ,用熔盐法直接电解金红石可获得金属钛,金红石所属的晶体类型是______________________________________晶体。
,用熔盐法直接电解金红石可获得金属钛,金红石所属的晶体类型是______________________________________晶体。 键
键  键
键  )。
)。

 ,反应达到平衡后,H2的体积分数甲_______乙(填“>’’‘‘=”或“<”)。
,反应达到平衡后,H2的体积分数甲_______乙(填“>’’‘‘=”或“<”)。