| A.反应中KNO3为还原剂 |
| B.NaN3中氮元素为-3价 |
| C.标准状况下,若有6.5gNaN3参加反应,则生成3.584L N2 |
| D.若1mol KNO,参加反应,转移电子的物质的量为10mol |
| A.9g18O2含有的中子数为5NA |
| B.标准状况下,0.5NABr2所占的体积约为11.2L |
| C.常温下,1L0.1mol·L-1NH4NO3溶液中含有的NH4+数为0.1NA |
| D.一定条件下,lmol N2和3mol H2在密闭容器充分反应,生成N-H键的数目为6NA |
| A.反应后的溶液中加入氯水不变色 |
| B.反应后的溶液可继续溶解金属铜 |
C.原混台物中氧化铁的物质的量为 (a-b)mol (a-b)mol |
| D.原混合物中单质铁的物质的量为b mol |

| A.装置①中负极反应式为H2+2e一=2H+ |
| B.装置①工作时,外电路电子由a电极流向b电极 |
| C.若采用装置②精炼铜,则d为粗铜,c为纯铜 |
| D.若装置②用惰性电极电解稀H2SO4溶液,则溶液pH升高 |
| A.往水中滴加少量氢氧化钠稀溶液,Kw变小 |
| B.往AgCl悬浊液中加入0.1mol·L-1NaI溶液,无明显现象产生 |
| C.室温下,稀释0.1mol·L-1的醋酸,溶液中c(CH3COO-)·c(H+)不变 |
| D.等体积等浓度的氨水与盐酸混合后所得溶液显酸性 |
 3Z(g) △H<0的图像正确的是
3Z(g) △H<0的图像正确的是

| A.甲可用来证明碳的非金属性比硅强 |
| B.乙装置可用于碘水中碘的萃取及分液 |
| C.用丙图示的方法检查此装置的气密性 |
| D.丁装置:从①进气可收集NO;从②进气可收集NH3 |
| A.漂白粉长时间露置空气中会结块变质 |
| B.金属钠在空气中燃烧产生黄色火焰,生成淡黄色固体 |
| C.为防船体被腐蚀,远洋货轮船底外壳镶嵌锌块,其中锌发生还原反应 |
| D.两根分别蘸有浓盐酸、浓氨水的玻璃棒靠近有白烟产生 |
| A.苯与氯气在一定条件下可发生取代反应 |
| B.塑料、纤维都是合成高分子材料 |
| C.乙烯、氯乙烯均可使酸性高锰酸钾溶液褪色 |
| D.油脂、纤维紊和蛋白质在一定条件下都能发生水解反应 |
| A.CO2、NO2或SO2都会导致酸雨的形成 |
| B.利用丁达尔效应可区别蛋白质溶液和氢氧化铝胶体 |
| C.煤经过气化和液化等物理变化后可以转化为纯净物 |
| D.新型氢动力计程车的投入使用有益于减少雾霾的产生 |
| A.乙醇的结构筒式:C2H6O |
B.CH4的比例模型: |
C.工业上制取粗硅的化学方程式:SiO2+C Si+CO2↑ Si+CO2↑ |
| D.电解饱和食盐水的离子方程式:Cl-+2H2O=Cl2↑+2OH-+H2↑ |
| A.原子半径:F<O<Al | B.稳定性:H2O<PH3<NH3 |
| C.酸性:H2CO3<H2SO4<H3PO4 | D.碱性:LiOH<NaOH<Al(OH)3 |
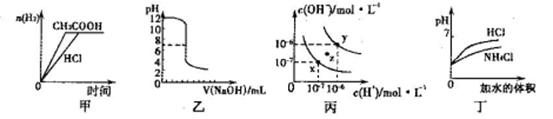
| A.甲图曲线表示向等体积、等物质的量浓度的盐酸和醋酸溶液中分别加人足量镁粉产生H2的物质的量的变化 |
| B.乙表示将0.01mol·L-lNaOH溶液滴人到稀盐酸中的滴定曲线 |
| C.丙为水的电离曲线,从z点刭x点,可采用在水中加入适量NaOH固体的方法 |
| D.丁中曲线表示将pH相同的NH4C1溶液和盐酸稀释相同倍数时,二者pH的变化 |


 R—CHO;
R—CHO;
 键与
键与 个数的比值为___________________。
个数的比值为___________________。


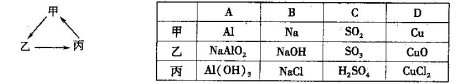
 乙
乙 丙,若其中甲是单质,乙、丙为化合物,x是具有氧化性的无色气体单质,则甲的化学组成不可能是________(选填序号,下同)。
丙,若其中甲是单质,乙、丙为化合物,x是具有氧化性的无色气体单质,则甲的化学组成不可能是________(选填序号,下同)。



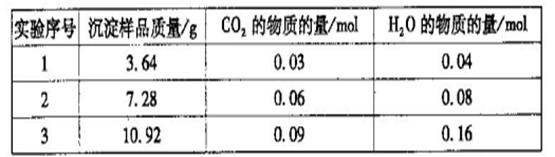
 FeCO3(s)+H2CO3(aq)的平衡常数为_______。
FeCO3(s)+H2CO3(aq)的平衡常数为_______。