适用年级:{{getGradeNameByProperty('高三|月考试卷|福建|2011年')}} 试卷类型:{{getTestPaperTypeName('高三|月考试卷|福建|2011年')}} 使用省份:{{getAreaName('高三|月考试卷|福建|2011年')}}
试卷年份:{{getYear('高三|月考试卷|福建|2011年')}}上传日期:2011-12-29题数:24
提示:单击题文可显示答案与解析。
题号:3302368
题型:选择题
难易度:一般
日期:2011-12-29
来源:2012届福建省厦门六中高三12月月考化学试卷
【题文】700℃时,向容积为2L的密闭容器中充入一定量的CO和H
2O,发生反应:
CO(g)+H
2O(g)

CO
2+H
2(g) 反应过程中测定的部分数据见下表(表中t
2>t
1):
反应时间/min
| n(CO)/mol
| n(H2O)/ mol
|
0
| 1.20
| 0.60
|
t1
| 0.80
|
|
t2
|
| 0.20
|
下列说法错误的是
A.反应在t
1min内的平均速率为
v(H
2)=0.20/t
1 mol·L
-1·min
-1B. 该反应条件下,CO的平衡转化率为33.3%
C.保持其他条件不变,向平衡体系中再通入0.20molH
2O,与原平衡相比,达到新平衡时CO转化率增大,H
2O的体积分数增大
D.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
题号:3302369
题型:选择题
难易度:一般
日期:2011-12-29
来源:2012届福建省厦门六中高三12月月考化学试卷
【题文】将过量CO
2通入NaOH和Ca(OH)
2的混合稀溶液中,生成沉淀的质量(m)和通入CO
2(V)关系图,正确的是

题号:3302370
题型:选择题
难易度:一般
日期:2011-12-29
来源:2012届福建省厦门六中高三12月月考化学试卷
【题文】用N
A表示阿伏加德罗常数的值。下列叙述正确的是
| A.常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA |
| B.标准状况下,22.4L乙醇中共价键数目为8NA |
| C.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA |
| D.1L浓度为1mol·L-1的Na2CO3溶液中含有NA个CO32- |
题号:3302371
题型:选择题
难易度:较难
日期:2011-12-29
来源:2012届福建省厦门六中高三12月月考化学试卷
【题文】X、Y、Z三种物质间存在如下图所示的转化关系。下列说法错误的是

| A.若Y是Al(OH)3,则X可以是AlCl3或Na[Al(OH)4] |
| B.若a是铁单质,则X可以是氯气、溴单质或稀硝酸 |
| C.若Z是CO2,则X可以是碳酸钠 |
| D.若a是氧气,则X只可能是碳单质、硫单质或氮气 |
题号:3302372
题型:选择题
难易度:一般
日期:2011-12-29
来源:2012届福建省厦门六中高三12月月考化学试卷
【题文】在一定条件下,Na
2CO
3溶液存在水解平衡:CO
32- + H
2O

HCO
3-+OH
-。下列说法错误的是
A.稀释溶液, 增大 增大 | B.通入CO2,溶液PH减小 |
| C.升高温度,水解平衡常数增大 | D.加入NaOH固体,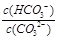 减小 减小 |
题号:3302373
题型:选择题
难易度:一般
日期:2011-12-29
来源:2012届福建省厦门六中高三12月月考化学试卷
【题文】下列离子方程式与所述事实相符且正确的是:
| A.漂白粉溶液通入少量SO2:2ClO-+SO2+Ca2++H2O=2HClO+CaSO3↓ |
B.用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl- Mn2++Cl2↑+2H2O Mn2++Cl2↑+2H2O |
| C.用Al单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解可生成白色难溶物,阳极的电极反应式为:Al - 3e--+3HCO3-=Al(OH)3↓+3CO2↑ |
| D.在强碱溶液中,次氯酸钠与Fe(OH)3反应生成Na2FeO4: |
3ClO
-+2Fe(OH)
3=2FeO
42-+3Cl
-+H
2O+4H
+
题号:3302374
题型:选择题
难易度:一般
日期:2011-12-29
来源:2012届福建省厦门六中高三12月月考化学试卷
【题文】以下实验或操作不能达到目的的是
| A.用溴水鉴别苯、乙醇、四氯化碳三种无色液体 |
| B.为除去甲烷气体中的少量乙烯,可将气体通入KMnO4溶液中 |
| C.为除去乙酸乙酯中的少量乙酸,可向混合物中加入适量的饱和碳酸钠溶液后分液 |
| D.用激光笔检验淀粉溶液的丁达尔现象 |
题号:3302375
题型:选择题
难易度:一般
日期:2011-12-29
来源:2012届福建省厦门六中高三12月月考化学试卷
【题文】下列说法错误的是
| A.还原性:Fe2+>I—>Br—>Cl— |
| B.氧化性:Fe3+> Cu2+>Zn2+ |
| C.酸性:H2SO4>CH3COOH> H2CO3>HClO |
| D.常温下跟钠反应的剧烈程度:乙酸> 水>乙醇 |
题号:3302376
题型:选择题
难易度:一般
日期:2011-12-29
来源:2012届福建省厦门六中高三12月月考化学试卷
【题文】短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等。X、Y也是短周期主族元素,且X
+、Y
2-的核外电子排布相同。下列说法错误的是

| A.非金属性:Q <W |
| B.Q、R、W三种元素的常见单质中所含微粒间的作用力完全相同 |
| C.原子半径:X>T;离子半径:X+<Y2- |
| D.T单质能与X的最高价氧化物的水化物反应 |
题号:3302377
题型:选择题
难易度:一般
日期:2011-12-29
来源:2012届福建省厦门六中高三12月月考化学试卷
【题文】下表四组实验中“操作及现象”与“溶液”对应关系错误的是
选项
| 溶液
| 操作及现象
|
A
| BaCl2溶液
| 通入SO2,无明显现象。再通入Cl2,溶液变浑浊。
|
B
| BaCl2溶液
| 通入SO2,无明显现象。再通入NH3,溶液变浑浊。
|
C
| Ca(ClO) 2溶液
| 通入过量CO2,溶液变浑浊。再加入品红溶液,红色褪去。
|
D
| Na[Al(OH)4]溶液
| 通入过量CO2,溶液变浑浊。再加入过量盐酸,浑浊消失,且有气泡产生。
|
题号:3302378
题型:选择题
难易度:一般
日期:2011-12-29
来源:2012届福建省厦门六中高三12月月考化学试卷
【题文】下列除杂或鉴别方法正确的是
| A.用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液 |
| B.用点燃的方法除去CO2中的CO |
| C.用加热法除去Na2CO3溶液中的NaHCO3 |
| D.用品红溶液或酸性KMnO4溶液鉴别 CO2和SO2 |
题号:3302379
题型:选择题
难易度:一般
日期:2011-12-29
来源:2012届福建省厦门六中高三12月月考化学试卷
【题文】下列说法错误的是
| A.清晨茂密树林中缕缕阳光穿过枝叶铺洒在地面形成的美丽景色与胶体的性质有关 |
| B.元素周期律是元素原子核外电子排布随着元素核电荷数的递增发生周期性变化的必然结果 |
| C.尿素[CO(NH2)2]的合成突破了无机物和有机物的界限,人们用含碳无机物为原料合成了大量的有机物,创造了一个新的“自然界” |
| D.Na2CO3俗名小苏打,是焙制糕点所用发酵粉的主要成分之一 |
题号:4336809
题型:选择题
难易度:一般
日期:2013-05-27
来源:2012届福建省厦门六中高三12月月考化学试卷
【题文】为证明CuSO
4溶液显蓝色与Cu
2+有关而与SO
42-无关,某同学设计了以下实验,其中对实验目的没有意义的是
| A.观察硫酸溶液呈无色 |
| B.观察硫酸铜粉末呈白色 |
| C.往CuSO4溶液中滴加足量NaOH溶液,生成蓝色沉淀,过滤,滤液呈无色 |
| D.往CuSO4溶液中滴加足量Ba(NO3)2溶液,生成白色沉淀,过滤,滤液仍显蓝色 |
题号:4337812
题型:选择题
难易度:较易
日期:2013-03-14
来源:2012届福建省厦门六中高三12月月考化学试卷
【题文】在下列溶液中,各组离子一定能够大量共存的是:( )
| A.使酚酞试液变红的溶液: Na+、Cl-、SO42-、Fe3+ |
| B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl- |
| C.c(H+)=10-12 mol·L-1的溶液:K+、Ba2+、Cl-、Br- |
| D.碳酸氢钠溶液:K+、SO42-、Cl-、H+ |
题号:4343535
题型:选择题
难易度:一般
日期:2011-12-29
来源:2012届福建省厦门六中高三12月月考化学试卷
【题文】下列关于硅单质及其化合物的说法正确的是
①硅是构成一些岩石和矿物的基本元素, 在自然界中只以化合态的形式存在
②陶瓷、水泥、玻璃、水晶饰物都是硅酸盐制品
③硅的最高价氧化物不与任何酸反应
④二氧化硅是高熔点、硬度大的原子晶体,广泛用作光导纤维
⑤硅的气态氢化物比甲烷不稳定
题号:4343536
题型:选择题
难易度:一般
日期:2012-09-05
来源:2012届福建省厦门六中高三12月月考化学试卷
【题文】下列有关化学用语表示正确的是
A.N2的电子式: |
B.S2-的结构示意图: |
| C.质子数为53,中子数为78的碘原子:53131I |
| D.乙烯的结构简式:CH2CH2 |
题号:4343537
题型:选择题
难易度:一般
日期:2012-07-31
来源:2012届福建省厦门六中高三12月月考化学试卷
【题文】甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH
3OH(g)+H
2O(g)=CO
2(g)+3H
2(g);△H=+49.0 kJ/mol
②CH
3OH(g)+1/2O
2(g)=CO
2(g)+2H
2(g);△H=-192.9 kJ/mol
下列说法错误的是
| A.1mol CH3OH(g)完全燃烧放出的热量大于192.9 kJ |
| B.根据反应①和②推知反应: H2(g)+1/2O2(g)=H2O(g)的△H=-241.9kJ/mol |
| C.CH3OH转变成H2的过程不一定要吸收能量 |
| D.反应①中的能量变化如图所示 |

题号:4343538
题型:选择题
难易度:一般
日期:2012-07-31
来源:2012届福建省厦门六中高三12月月考化学试卷
【题文】下列实验对应的结论不正确的是

| A.能组成Zn、Cu原电池 |
| B.能证明非金属性Cl>C>Si |
C.说明反应2NO2 N2O4(无色),△H<0 N2O4(无色),△H<0 |
| D.白色沉淀为BaSO4 |
题号:4343539
题型:选择题
难易度:
日期:2011-12-29
来源:2012届福建省厦门六中高三12月月考化学试卷
【题文】化学在生产和日常生活中有着重要的应用。下列说法不正确的是:
| A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 |
| B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
| C.MgO 的熔点很高,可用于制作耐高温材料 |
| D.电解MgCl2饱和溶液,可制得金属镁 |
题号:3302363
题型:实验题
难易度:较难
日期:2011-12-29
来源:2012届福建省厦门六中高三12月月考化学试卷
【题文】(13分)无水氯化镁是制备某种催化剂的中间体。某研究性学习小组设计实验方案进行制取无水氯化镁等实验。请填写下列空白。
[实验一]利用下图实验装置(夹持和加热装置省略),在HCl气流中小心加热MgCl
2·6H
2O晶体制取无水氯化镁(无水氯化镁易吸水)。烧瓶中发生的反应为:
NaCl+H
2SO
4(浓)===NaHSO
4+HCl↑

(1)试剂X是
。第二个洗气瓶中的浓硫酸的作用是
(2)该实验装置存在一个缺陷是
。
[实验二]通过下列步骤,测定实验一所得产物中氯元素含量以确定产物是否含有结晶水:
①称取m
1g样品置于烧杯中,充分溶解;
②加入足量硝酸银溶液,充分反应后,过滤;
③洗涤沉淀,干燥至恒重,称得沉淀质量为m
2g。
(3)若步骤③的操作中未洗涤沉淀,将导致测得的氯元素含量
(填“偏高”或“偏低”)
(4)若测得m
1=10.40,m
2=28.70,则所得产品MgCl
2·nH
2O中n的值为
。
[实验三]一定条件下,氯化镁与四氯化钛的混合物可作烯烃聚合反应的催化剂。为了探究温度、氯化镁固体的含水量以及粉碎方式对该催化剂催化效果的影响,设计如下对比实验:
实验序号
| 氯化镁固体中氯元素含量/%
| 温度/℃
| 粉碎方式
| 催化效果/g·g-1
|
1
| 70.97
| 20
| 滚动球磨
| 3.9×104
|
2
| 74.45
| 20
| 滚动球磨
| 5.0×104
|
3
| 74.45
| 20
| 振动球磨
| 5.9×104
|
4
| ω
| 100
| 振动球磨
|
|
注:催化效果用单位时间内每克催化剂得到产品的质量来表示
(5)表中ω=
。
(6)从实验1、2可以得出的结论是
。
(7)设计实验2、3的目的是
。
题号:3302364
题型:实验题
难易度:较难
日期:2011-12-29
来源:2012届福建省厦门六中高三12月月考化学试卷
【题文】.(14分) 硫代硫酸钠(Na
2S
2O
3)是常用的还原剂。在维生素C(化学式C
6H
8O
6)的水溶液中加入过量I
2溶液,使维生素完全氧化,剩余的I
2用Na
2S
2O
3标准溶液滴定,可测定溶液中维生素C的含量。发生的反应为:
C
6H
8O
6+I
2===C
6H
6O
6+2H
++2I
- 2S
2O
32-+I
2===S
4O
62-+2I
-在一定体积的某维生素C溶液中加入1.2molL
-1 I
2溶液25ml,充分反应后,用1.0molL
-1Na
2S
2O
3标准溶液滴定剩余的I
2。请回答下列问题:
(1)配制100mL 1.0molL
-1 Na
2S
2O
3标准溶液,使用的仪器除天平、药匙、胶头滴管外,还需要___________________________________;配制时,用胶头滴管加水定容至刻度线并盖上瓶塞后的下一步操作是_______________________________________
(2)滴定时,可选择_________________作指示剂。滴定时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视_____________________________________。直到出现________________________________________现象为止。
(3)若滴定开始和结束时,滴定管中的液面如图所示。反应消耗Na
2S
2O
3标准溶液的体积是_______________。试根据该实验数据计算该溶液中维生素C的物质的量:
mol。

(4)判断下列操作对该溶液中维生素C的物质的量测定结果的影响(填“偏高”、“偏低”或“无影响”)
若在配制标准溶液过程中,烧杯中的Na
2S
2O
3溶液有少量溅出,使测定结果_______;
若在滴定终点读取滴定管刻度时,仰视标准液液面,使测定结果_________
题号:3302365
题型:填空题
难易度:较难
日期:2011-12-29
来源:2012届福建省厦门六中高三12月月考化学试卷
【题文】(9分)工业废水中常含有一定量的Cr
2O
72—和CrO
42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为

其中第①步存在平衡:2CrO
42—(黄色)+2H
+
Cr
2O
72—(橙色)+H
2O
(1)该反应体系的平衡常数表达式为:
(2)若平衡体系的pH=2,则溶液显
色.
(3)能说明第①步反应达平衡状态的是
。
a.溶液的颜色不变 b.2v (Cr
2O
72—) ="v" (CrO
42—)
c. Cr
2O
72—和CrO
42—的浓度相同
(4)完成第②步反应的离子方程式:
__Cr
2O
72—+ __Fe
2+ +_____="__" Cr
3+ + __Fe
3+ +__ H
2O
(5)第③步生成的Cr(OH)
3在溶液中存在以下沉淀溶解平衡:
Cr(OH)
3(s)

Cr
3+(aq)+3OH
—(aq)
常温下,Cr(OH)
3的溶度积Ksp=c(Cr
3+)· c
3(OH
—)=10
-32,要使c(Cr
3+)降至10
-5mol/L,溶液的pH应调至
。
方法2:电解法
该法用Fe做电极电解含Cr
2O
72—的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)
3沉淀。
(6)写出电解过程中的电极反应式:
阳极:
。阴极:
。
(7)溶液中同时生成的沉淀还有
。
题号:3302366
题型:填空题
难易度:较难
日期:2011-12-29
来源:2012届福建省厦门六中高三12月月考化学试卷
【题文】(15分)A、B、C、D、E、F五种短周期元素的原子序数依次增大。周期表中A元素的原子半径最小,B形成化合物种类最多,C是空气中含量最多的元素,D是地壳中含量最多的元素,短周期主族元素中E的原子半径最大且其单质能与冷水剧烈反应,F既能与盐酸反应也能与烧碱溶液反应制得A单质。
(1)B在周期表中的位置是____________________,C的原子结构示意图为________
(2)A、B形成的最简单化合物名称是___________,分子构型是__________________
(3)BD2的结构式为:__________。已知:298K,BD生成1molBD2(g)时放出热量283.0kJ·mol-1,B单质生成1molBD2(g)时放出热量393.5kJ·mol-1,则B单质反应生成BD的热化学方程式为 。
(4)室温时,仅由B、D、E三种元素形成的某种常见的离子化合物水溶液的pH_____7(填“>”、“=”或“<”),理由是(用离子方程式表示)_________________________________
(5)硒(se)是人体必需的微量元素,与D同一主族,Se原子比D原子多两个电子层,则Se的原子序数为_______,其最高价氧化物对应的水化物化学式为_________。
(6)F的最高价氧化物与E的最高价氧化物的水化物反应的离子方程式是
__________________________________________________________
(7)A单质和D单质可组成最简单的燃料电池,若用稀硫酸作电解质,该电池的正极反应式是:______________________________________________
题号:3302367
题型:填空题
难易度:一般
日期:2011-12-29
来源:2012届福建省厦门六中高三12月月考化学试卷
【题文】(7分)
(1)在25℃条件下将pH=3的醋酸稀释100倍后溶液的pH为
(2)常温下,pH=3的盐酸和pH=11的氨水等体积混合后,混合溶液中
c(Cl
-)
c(NH
4+)(填“>”、“=”或“<”)。
(3)常温下,已知某CH
3COONa溶液中的c(Na
+)=c(CH
3COO
一),则该溶液的pH
7(填“>”、“=”或“<”)。
(4)如果将NaOH和NH
4Cl溶液等浓度、等体积混合,则混合溶液中各离子浓度由大到小的顺序为:c( )
c( )
c( )
c( )
c( )
[括号内填离子符号,“
”上填写“>”或“=”]
(5)常温下等物质的量浓度的下列溶液中,①NH
4Al(SO
4)
2、②NH
4Cl、③CH
3COONH
4、④NH
3·H
2O;
c(NH
4+) 由大到小的顺序是:_____________________________(填序号)
 CO2+H2(g) 反应过程中测定的部分数据见下表(表中t2>t1):
CO2+H2(g) 反应过程中测定的部分数据见下表(表中t2>t1):

 HCO3-+OH-。下列说法错误的是
HCO3-+OH-。下列说法错误的是 增大
增大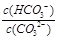 减小
减小 Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O




 N2O4(无色),△H<0
N2O4(无色),△H<0


 Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O Cr3+(aq)+3OH—(aq)
Cr3+(aq)+3OH—(aq)