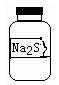适用年级:{{getGradeNameByProperty('高三|月考试卷|福建|2011年')}} 试卷类型:{{getTestPaperTypeName('高三|月考试卷|福建|2011年')}} 使用省份:{{getAreaName('高三|月考试卷|福建|2011年')}}
试卷年份:{{getYear('高三|月考试卷|福建|2011年')}} 上传日期:2011-11-03 题数:11
题号:3310174
题型:选择题
难易度:一般
日期:2011-11-03
来源:2012届福建省厦门六中高三10月月考化学试卷
【题文】下列说法正确的是
A.1mol Na2 O2 共约含有1.809×1024 个离子 B.含有4mol HCl的浓盐酸与足量的MnO2 充分反应可制得标准状况下的Cl2 22.4L C.配制250mL 1.0mol·L-1 的硫酸溶液需密度为1.84g·cm-3 的98%浓硫酸约13.6mL D.0.1mol·L-1 的醋酸溶液的pH=1
题号:3310175
题型:选择题
难易度:一般
日期:2011-11-03
来源:2012届福建省厦门六中高三10月月考化学试卷
【题文】下列实验推理中,错误的是
A.用酒精灯加热一小片铝箔,熔化的铝不会滴落, 说明氧化铝的熔点高于铝 B.某种气体通入品红溶液中,品红褪色,加热后溶液又会出现红色, 该气体一定是SO2 C.焰色反应时观察到黄色火焰,说明样品中一定含钠元素可能含钾元素 D.某试管中的溶液中加入NaOH溶液后,在试管口放置一红色石蕊试纸, 试纸始终不变蓝色, 说明该溶液中一定不含有NH4 +
题号:3310176
题型:选择题
难易度:一般
日期:2011-11-03
来源:2012届福建省厦门六中高三10月月考化学试卷
【题文】已知室温下某溶液中c(OH
- )=1.0×10
-13 mol·L
-1 。下列离子组在该溶液中能大量共存的是
A.OH- 、Na+ 、SO4 2- 、Ba2+ B.NO3 - 、Na+ 、SO4 2- 、Fe2+ C.ClO- 、Na+ 、SO4 2-- 、K+ D.NO3 - 、Na+ 、Cl- 、Ca2+
题号:3310177
题型:选择题
难易度:一般
日期:2011-11-03
来源:2012届福建省厦门六中高三10月月考化学试卷
【题文】下列有关有机物的说法正确的是
A.聚氯乙烯塑料最适合用来做蔬菜、水果及熟食等的保鲜膜 B.淀粉、蛋白质、油脂、纤维素都属于天然高分子化合物 C.乙烯使溴水、酸性高锰酸钾溶液褪色的本质是不同的 D.等物质的量的CH4 与Cl2 恰好反应时,生成CH3 Cl与HCl
题号:4349481
题型:选择题
难易度:较易
日期:2013-01-22
来源:2012届福建省厦门六中高三10月月考化学试卷
【题文】依据元素周期律及元素周期表,下列推断错误的是:
A.非金属性:O>C>Si B.半径: K+ > Cl- > S2- C.还原性: HI>HBr>HCl D.稳定性: H2 O>NH3 >CH4
题号:4349482
题型:选择题
难易度:一般
日期:2011-11-03
来源:2012届福建省厦门六中高三10月月考化学试卷
【题文】下表各组物质中,物质之间不可能实现如图所示转化的是
选项 X Y Z M ① Al3+ Al(OH)3 [Al(OH)4 ]- NaOH ② [Al(OH)4 ]- Al(OH)3 Al3+ HCl ③ Fe FeCl2 FeCl3 Cl2 ④ Cl2 FeCl3 FeCl2 Fe ⑤ NaOH Na2 CO3 NaHCO3 CO2 ⑥ NH3 NO NO2 O2 ⑦ C2 H5 OH CH3 CHO CH3 COOH O2 ⑧ H2 S SO2 SO3 O2
A. 只有③ B. ③④ C. ④⑥⑧ D. ②③⑦
题号:4349483
题型:选择题
难易度:
日期:2011-11-03
来源:2012届福建省厦门六中高三10月月考化学试卷
【题文】实验室一瓶固体M的标签右半部分已被腐蚀,剩余部分只看到“Na
2 S”字样(如图所示)。已知,固体M只可能是Na
2 SO
3 、Na
2 SiO
3 、Na
2 SO
4 中的一种。若取少量固体M配成稀溶液进行有关实验,下列说法不正确的是
A.只用盐酸一种试剂就可以确定该固体M的具体成分 B.往溶液中通入二氧化碳,若有白色沉淀,则固体M为Na2 SiO3 C.往溶液中加入稀硝酸酸化的BaCl2 ,若有白色沉淀,则固体M为Na2 SO4 D.用pH试纸检验,若pH=7,则固体M一定是Na2 SO4
题号:3310170
题型:实验题
难易度:较难
日期:2011-11-03
来源:2012届福建省厦门六中高三10月月考化学试卷
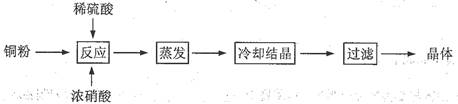
【题文】(13分) CuSO
4 ·5H
2 O是铜的重要化合物,有着广泛的应用。以下是CuSO
4 ·5H
2 O的实验室制备流程图。
根据题意完成下列填空:
(1)向含铜粉的稀硫酸中滴加浓硝酸,在铜粉溶解时可以观察到的实验现象:
、
。
(2)有同学认为此种方法会生成有毒的氮的氧化物, 且所得晶体可能混有硝酸铜。建议将浓硝酸换成其它氧化剂,你觉得呢?若有同感,请选择合适的试剂完成下列反应(若有反应条件的应注明):
__Cu + __H
2 SO
4 + __________→ __CuSO
4 +_______________
(3)已知:CuSO
4 +2NaOH=Cu(OH)
2 ↓+ Na
2 SO
4 相对分子质量:CuSO
4 :160 H
2 O:18
称取0.1000 g提纯后的CuSO
4 ·5H
2 O试样于锥形瓶中,加入0.1000 mol/L氢氧化钠溶液28.00 mL,反应完全后,过量的氢氧化钠用0.1000 mol/L盐酸滴定至终点,耗用盐酸20.16 mL,则该试样中含CuSO
4 ·5H
2 O的质量分数为
。
(4)上述滴定中,滴定管在注入盐酸之前,先用蒸馏水洗净,再用
。
(5)如果采用重量法测定CuSO
4 ·5H
2 O的含量,完成下列步骤:
①称取样品a g②加水溶解③加氯化钡溶液,沉淀④过滤、
、干燥⑤称量所得固体b g。
在过滤前,需要检验是否沉淀完全,其操作是
则a g该试样中含CuSO
4 ·5H
2 O的质量为
g (用含b的代数式表示)。
[相对原子质量:H-1 O-16 S-32 Ba-137]
题号:3310171
题型:实验题
难易度:较难
日期:2011-11-03
来源:2012届福建省厦门六中高三10月月考化学试卷
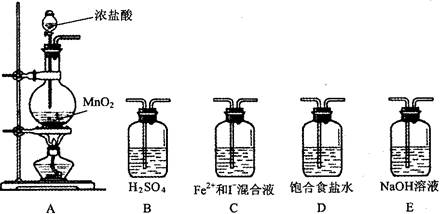
【题文】(15分)某研究性小组设想将少量Cl
2 通入Fe
2+ 和I
- 的混合溶液中,探究Fe
2+ 和I
- 的还原性强弱。
[提出假设]
假设1:Fe
2+ 的还原性比I
- 强
假设2:I
- 的还原性比Fe
2+ 强
假设1:一样强
[验证假设]
(1)设计如下几种装置进行实验:
实验必须的装置是A→_______________(按Cl
2 气流方向的顺序填写)
(2)实验开始后,控制通入少量Cl
2 ,通过观察混合溶液颜色的变化_________(填“能”或“不能”)判断反应的先后顺序。
(3)请在下表中写出实验步骤及预期现象和结论:
实验步骤 预期现象和结论 取少量反应后的混合溶液分置于A、B两试管中; ①若_______________________________
(4)为了实验成功,必须控制各物质的用量。该小组称取1.52 g FeSO
4 ,同时称取1.66g KI固体,溶于水中。为了验证上述假设,通入的Cl
2 体积最多不能超过__________L(标准状况)。[相对分子质量:FeSO
4 :152 KI :166 ]
[思考与交流]
(5)有同学质疑,上述实验只能验证Cl
2 分别与Fe
2+ 和I
- 反应的速率大小,并不能证明Fe
2+ 和I
- 的还原性强弱。于是提出另一方案:往KI溶液中滴入__________溶液,如果能发生反应,即可证明和I
- 的还原性强于Fe
2+ 。该反应的离子方程式为:____________________
题号:3310172
题型:实验题
难易度:较难
日期:2011-11-03
来源:2012届福建省厦门六中高三10月月考化学试卷
【题文】(14分)下图所示装置是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去)。请根据下列要求回答问题。
(1)若烧瓶中盛装Zn片,分液漏斗中盛装稀H
2 SO
4 ,则:
①当制备H
2 、验证H
2 的还原性并检验H
2 的氧化产物,仪器连接顺序为:A→C→B
→B→D时,两次使用B装置,其中所盛的药品依次是
、
(写化学式);D装置的作用是
。
②上述实验中为了使H
2 产生的速率不至于过快,在不改变现有药品的条件下,可采取的方法有
、
。(要求:写出的两种方法原理不同)
(2)若烧瓶中盛装Na
2 O
2 ,分液漏斗中盛装浓氨水,则:
①烧瓶内除了能产生O
2 外,还能产生大量NH
3 。能产生大量NH
3 的原因是:
a ;
b ;
c 。
②用产生的气体做氨的催化氧化实验,各仪器装置按气流方向(从左到右)连接顺序是:A→
→
→
(填正确序号的字母)此时在其中的一个装置中可能会出现大量红棕色气体,该装置是
(用字母表示);用化学方程式解释红棕色气体产生的原因:
、
。
题号:3310173
题型:填空题
难易度:困难
日期:2011-11-03
来源:2012届福建省厦门六中高三10月月考化学试卷
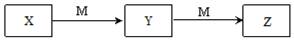
【题文】(16分)X、Z、Q、R 4种短周期元素原子序数的依次增大,Y是一种短周期主族非金属元素。化合物甲由X、Z、Q 3种元素组成,常温下,0.1mol·L
-1 甲溶液的pH=13。工业上常用电解QR饱和溶液生产甲。请填写下列空白。
(1)Q的原子结构示意图为
。
(2)电解QR饱和溶液反应的离子方程式为
。
(3)常温下将R的单质通入甲溶液中,发生反应的离子方程式为
。
(4)①若Y与X组成的气体化合物乙在常温下遇XR气体时产生白烟,则乙的化学式为
;YZ
2 与水反应的化学方程式:________________________________________
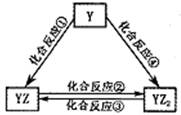
②若Y元素的单质能发生如图所示转化,则Y元素名称是
。YZ
2 的结构式为:_____________YZ
2 通过置换反应可生成Y的单质,该反应式为:____________________________________
③若Y元素的单质是一种淡黄色固体。写出Y的最高价氧化物的水化物的浓溶液与铜共热的化学方程式:______________ ____________________________________
④若Y的最高价氧化物可制光导纤维。写出工业生产Y单质的反应的化学方程式:____________________________________________________________