适用年级:{{getGradeNameByProperty('高三|月考试卷|福建|2011年')}} 试卷类型:{{getTestPaperTypeName('高三|月考试卷|福建|2011年')}} 使用省份:{{getAreaName('高三|月考试卷|福建|2011年')}}
试卷年份:{{getYear('高三|月考试卷|福建|2011年')}}上传日期:2011-04-21题数:20
提示:单击题文可显示答案与解析。
题号:4358122
题型:选择题
难易度:一般
日期:2011-04-21
来源:2011届福建省上杭一中高三12月月考化学试卷
【题文】信息、材料、能源被称为新科技革命的“三大支柱”。下列观点或做法错误的是
| A.在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源 |
| B.加大煤炭的开采速度,增加煤炭燃料的供应量,以缓解石油危机 |
| C.光缆在信息产业中有广泛应用,制造光缆的主要材料是二氧化硅 |
| D.高温结构陶瓷氮化硅(Si3N4)具有较高的硬度和耐磨性,可用于制造汽车发动机 |
题号:4358123
题型:选择题
难易度:一般
日期:2011-04-21
来源:2011届福建省上杭一中高三12月月考化学试卷
题号:4358124
题型:选择题
难易度:一般
日期:2011-04-21
来源:2011届福建省上杭一中高三12月月考化学试卷
【题文】将含有0.4mo

l Cu(N0
3)
2和0.3 mol KCl 的水溶液 1 L,用惰性电极电解一段时间后,在一个电极上析出 0.1 mol Cu ,此时要将溶液恢复到电解前溶液一样,可加入一定量的
| A.CuCl2 | B.CuO | C.Cu(OH)2 | D.CuCO3 |
题号:4358126
题型:选择题
难易度:一般
日期:2011-04-21
来源:2011届福建省上杭一中高三12月月考化学试卷
题号:4358127
题型:选择题
难易度:一般
日期:2011-04-21
来源:2011届福建省上杭一中高三12月月考化学试卷
【题文】下列反应中,产物不会随反应物量的改变而改变的是
| A.钠与氧气 | B.稀硫酸与铝片 | C.二氧化硫与氨水 | D.稀硝酸与铁粉 |
题号:4358128
题型:选择题
难易度:一般
日期:2011-04-21
来源:2011届福建省上杭一中高三12月月考化学试卷
【题文】N
A表示阿伏加德罗常数的值,下列说法中正确的是
| A.常温常压下,21g氧气和27g臭氧所含氧原子总数为3NA |
B.34 g H2O2中含阴离 子数为NA 子数为NA |
| C.饱和FeCl3溶液加入沸水中,若有1mol FeCl3水解,可生成NA个胶体粒子 |
| D.80mL 10mol/L浓盐酸与足量MnO2加热反应,转移电子数为0.4NA |
题号:4358129
题型:选择题
难易度:一般
日期:2011-04-21
来源:2011届福建省上杭一中高三12月月考化学试卷
【题文】在下列各指定溶液中,离子可能大量共存的是
| A.澄清透明的溶液中:Cu2+、Fe3+、NO3-、Cl- |
| B.使pH试纸变蓝的溶液中:NH4+、Na+、SO42-、Cl- |
| C.含有大量ClO-的溶液中:K+、OH-、I-、SO32- |
| D.c(Fe3+)=0.1mol/L的溶液中: K+、ClO-、SO42-、SCN- |
题号:4358130
题型:选择题
难易度:一般
日期:2011-04-21
来源:2011届福建省上杭一中高三12月月考化学试卷
【题文】某溶液中可能含有I
-、NH
4+、Cu
2+、SO
32-,向溶液中加入少量溴水,溶液呈无色。(提示:I
2+SO
2+2H
2O==2HI+H
2SO
4)则下列关于溶液组成的判断正确的是
①肯定不含I
- ②肯定不含Cu
2+ ③肯定含有SO
32- ④可能含有I
-
题号:4358131
题型:选择题
难易度:一般
日期:2011-04-21
来源:2011届福建省上杭一中高三12月月考化学试卷
【题文】下列化学实验事实及其解释都正确的是
| A.过量的铜屑与稀硝酸作用,反应停止后,再加入1mol/L稀硫酸,铜屑又逐渐溶解是因为铜可直接与1mol/L稀硫酸反应 |
| B.铁钉放在浓硝酸中浸泡后,再用蒸馏水冲洗,然后放入CuSO4溶液中不反应,说明铁钉表面形成了一层致密稳定的氧化膜 |
| C.粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强 |
| D.工业制玻璃的主要反应之一:高温下Na2CO3+SiO2=Na2SiO3+CO2↑;该反应原理可用“强酸H2CO3制弱酸H2SiO3”来解释 |
题号:4358132
题型:选择题
难易度:一般
日期:2011-04-21
来源:2011届福建省上杭一中高三12月月考化学试卷
【题文】下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
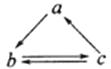
物质
选项
| a
| b
| c
|
A
| NaOH
| Na2CO3
| NaHCO3
|
B
| Na2SiO3
| Si
| SiO2
|
C
| HCl
| HClO
| Cl2
|
D
| S
| SO2
| SO3
|
题号:4358133
题型:选择题
难易度:一般
日期:2011-04-21
来源:2011届福建省上杭一中高三12月月考化学试卷
【题文】将0.1mol Cu与40ml 10mol/LHNO
3充分反应,测得反应后的溶液里含有a molH
+由此可知
| A.生成的气体一定是NO2,在标准状况下的体积4.48 L |
| B.生成的气体一定是NO,在标准状况下的体积约1.49L |
| C.被还原的硝酸的物质的量为(0.2-a)mol |
| D.反应后的溶液里含有0.2mol NO3- |
题号:4358134
题型:选择题
难易度:一般
日期:2011-04-21
来源:2011届福建省上杭一中高三12月月考化学试卷
【题文】一些烷烃的燃烧热如下表:
化合物
| 燃烧热/kJ·mol-1
| 化合物
| 燃烧热/kJ·mol-1
|
甲烷
| 891.0
| 正丁烷
| 2878.0
|
乙烷
| 1560.8
| 异丁烷
| 2869.6
|
丙烷
| 2221.5
| 异戊烷
| 3531.3
|
下列表达正确的是
A.正戊烷的燃烧热小于3531.3kJ·mol- 1 1 |
| B.稳定性:正丁烷>异丁烷 |
C.乙烷燃烧的热化学方程式为:
2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g) ;△H= -1560.8 kJ |
| D.相同物质的量的烷烃CnH2n+2,n越大,燃烧放出的热量越多 |
题号:4358135
题型:选择题
难易度:一般
日期:2011-04-21
来源:2011届福建省上杭一中高三12月月考化学试卷
【题文】下列有关物质检验的操作和实验结论都正确的是
选项
| 实验操作及现象
| 实验结论
|
A
| 向某溶液中先加入氯化钡溶液,有白色沉淀生成,再加盐酸酸化,沉淀不溶解
| 该溶液中一定含有SO42-
|
B
| 向某溶液中加入2滴KSCN溶液,溶液不显红色。再向溶液中加入几滴新制的氯水,溶液变为红色
| 该溶液中一定含有Fe2+
|
C
| 将某气体通入品红溶液中,品红溶液褪色
| 该气体一定是SO2
|
D
| 向某物质中加入NaOH并微热,产生无色气体。
| 该物质中一定含有NH4+
|
题号:4358136
题型:选择题
难易度:一般
日期:2011-04-21
来源:2011届福建省上杭一中高三12月月考化学试卷
【题文】下

列反应的离子方程式正确的是
A.AgCl不溶于稀硝酸,但可溶于氨水中:
AgCl +2 NH3·H2O = [Ag(NH3)2]++ Cl-+2H2O |
B.双氧水中滴加酸性高锰酸钾,溶液紫红色褪去:
6H++ 2MnO4-+ H2O2= 2Mn2+ + 3O2 ↑+ 4H2O |
C.在硫酸亚铁溶液中通入氧气:4Fe2++O2+2H2O= 4F e3++4 OH- e3++4 OH- |
| D.乙炔气体中混有的硫化氢,可通过盛有CuSO4溶液的洗气瓶:Cu2++ S2-= CuS↓ |
题号:4358137
题型:选择题
难易度:一般
日期:2011-04-21
来源:2011届福建省上杭一中高三12月月考化学试卷
【题文】某学习小组拟利用如下装置制备氮化钙(化学式:Ca
3N
2,极易与H
2O反应)
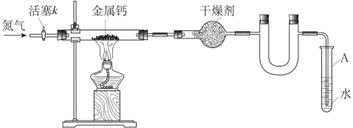

下列说法正确的是
| A.打开活塞K通入N2,试管A内有气泡产生,说明装置气密性良好 |
| B.U形管中盛放的干燥剂既可以用碱石灰,也可以用浓硫酸 |
| C.反应结束后,先熄灭酒精灯,待反应管冷却后再关闭活塞K |
| D.将产物Ca3N2放入盐酸中,只能得到一种盐 |
题号:4358141
题型:选择题
难易度:一般
日期:2011-04-21
来源:2011届福建省上杭一中高三12月月考化学试卷
【题文】为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是
| 被提纯的物质
| 除杂试剂
| 分离方法
|
A
| 溴化钠溶液(NaI)
| 氯水、CCl4
| 萃取、分液
|
B
| CO(CO2)
| 饱和NaHCO3溶液
| 洗气
|
C
| FeSO4(Fe 2(SO4)3) 2(SO4)3)
| 足量铁屑
| 过滤
|
D
| CO2(SO2)
| NaOH
| 洗气
|
题号:4358125
题型:实验题
难易度:一般
日期:2012-10-23
来源:2011届福建省上杭一中高三12月月考化学试卷
【题文】(12分)两组同学对铁及其化合物的性质进行探究。

(1)一组同学用图1所示装置对铁与浓硫酸的反应进行实验。
已知:2Fe + 6H
2SO
4(浓)
Fe
2(SO
4)
3 + 3SO
2↑+ 6H
2O。
请你参与探究并回答相关问题。
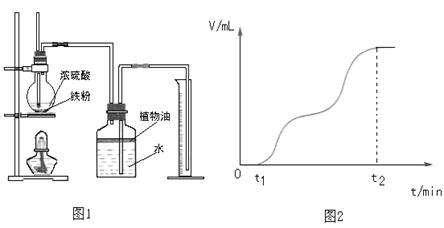
①检查装置气密性后,将过量的铁屑和一定量的浓硫酸放入烧瓶,塞紧橡皮塞,开始计时。t
1时开始加热,在铁屑表面逐渐产生气泡,当有大量气泡产生时,控制反应温度基本不变。甲同学将收集到的气体体积与时间的关系粗略地表示为图2。在0~t
1时间段,铁屑表面没有气泡生成,说明铁在浓硫酸中发生了
;t
1~t
2时间段,反应生成的气体是
。
②t
2时,取少量反应液,先滴加少量新制饱和氯水,然后滴加KSCN溶液,呈现血红色。若再滴加过量新制氯水,却发现红色褪去。同学们对红色褪去的原因提出各自的假设。乙同学的假设是:溶液中的+3价铁被氧化为更高的价态。
你的另一种假设是
;为了验证你的假设,请设计一种简便的实验方案
。[
(2)另一组同学对铁和稀硝酸的反应进行探究。他们用a mol Fe和含有b mol HNO
3的稀硝酸进行实验,若HNO
3只被还原成NO,且反应结束后溶液中含有Fe
3+和Fe
2+,则a/b的取值范围是
;为证实上述混合液中含有Fe
2+,可以采取这样的做法:先取样,再加入
试剂,观察到溶液发生明显的颜色变化时,可以说明Fe
2+的存在。
题号:4358138
题型:填空题
难易度:一般
日期:2011-04-21
来源:2011届福建省上杭一中高三12月月考化学试卷
【题文】(10分)水处理技术在工业生产和日常生活中有着重要应用。
(1)水处理絮凝剂包括无机絮凝剂和有机絮凝剂。无机絮凝剂如明矾,其原理用离子方程式表示为
;有机絮凝剂如聚丙烯酸钠。

(2)氯气进行自来水消毒时,起消毒杀菌作用的物质是
(写化学式),但用氯气消毒的水可能有臭味,长期饮用还可能对人造成潜在危害;ClO
2是一种消毒杀菌效率高、二次污染小的水处理剂,工业上可用SO
2与NaClO
3溶液反应制得,该反应离子方程是
。
(3)高铁酸钠(Na
2FeO
4)作为水处理剂兼具絮凝剂和消毒杀菌剂的作用,被科学家们公认为绿色消毒剂。Na
2FeO
 4
4用于消毒杀菌,是利用其
性;实验室采用次氯酸盐氧化法制高铁酸钠,在次氯酸钠溶液中加入氢氧化钠和硫酸铁,可制备高铁酸钠的稀溶液,该反应的离子方程式是
。
题号:4358139
题型:填空题
难易度:一般
日期:2011-04-21
来源:2011届福建省上杭一中高三12月月考化学试卷
【题文】(15分)铝、铁、铜是应用最普遍的金属。
(1)铜是印刷电路工业的重要材料。用H
2O
2和H
2SO
4的混合溶液可溶出印刷电路板金属粉末中的铜,是工业上采用的方法之一。已知
Cu(s) + 2H
+(aq) ="=" Cu
2+(aq) + H
2(g) △H= +64.39kJ/mol
2H
2O
2(l) ="=" 2H
2O(l) + O
2 (g) △H= ﹣196.46kJ/mol
H
2(g) +1/2 O
2 (g)="=" H
2O(l) △H= ﹣285.84kJ/mol
在H
2SO
4溶液中Cu和H
2O
2反应生成Cu
2+和H
2O的热化学方程式为
(2)镁铝合金生活中应用广泛。取样品a克,溶于200ml 5mol/L的HCl溶液,收集到标况下氢气3.36L,a的取值范围
,向反应后溶液中加入4mol/L NaOH溶液
ml,沉淀质量达到最

大

值。
(3)标准状况下,铁铜合金ag加入足量稀硝酸中,收集了一定量气体NO,在混合了67

.2mlO
2后,可完全被H
2O吸收,无气体剩余。则生成的NO为
ml;向反应后溶液加足量的NaOH溶液,得到沉淀的质量
g。(用含a的代数式表示)
题号:4358140
题型:填空题
难易度:一般
日期:2011-04-21
来源:2011届福建省上杭一中高三12月月考化学试卷
【题文】(15分)重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO·Cr
2O
3)为原料生产,实验室模拟工业法用铬铁矿制K
2Cr
2O
7的主要工艺如下,涉及的主要反应是:6FeO·Cr
2O
3+24NaOH+7KClO
3
12Na
2CrO
4+3Fe
2O
3 +7KCl+12H
2O,
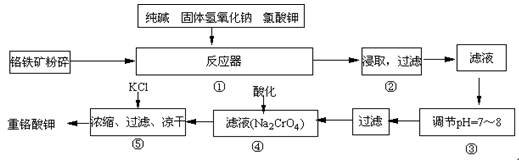
试回答下列问题:
(1)在反应器①中,有Na
2CrO
4生成,同时Fe
2O
3转变为NaFeO
2,杂质SiO
2、Al
2O
3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:
。
(2)操作③的目的是什么,用简要的文字说明:
。
(3)操作④中,酸化时,CrO
42-转化为Cr
2O
72-,写出平衡转化的离子方程式:
。
(4)称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL 2mol/LH
2SO
4和足量碘化钾(铬的还原产物为Cr
3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa
2S
2O
3标准溶液滴定。
(I
2+2S
2O
32-=2I
-+S
4O
62-)
①判断达到滴定终点的依据是:
;
②若实验中共用去Na
2S
2O
3标准溶液40.00mL,则所得产品中重铬酸钾的纯度(设整个过程中其它杂质不参与反应)
%(保留小数点后两位)。





 l Cu(N03)2和0.3 mol KCl 的水溶液 1 L,用惰性电极电解一段时间后,在一个电极上析出 0.1 mol Cu ,此时要将溶液恢复到电解前溶液一样,可加入一定量的
l Cu(N03)2和0.3 mol KCl 的水溶液 1 L,用惰性电极电解一段时间后,在一个电极上析出 0.1 mol Cu ,此时要将溶液恢复到电解前溶液一样,可加入一定量的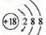

 子数为NA
子数为NA
 1
1 列反应的离子方程式正确的是
列反应的离子方程式正确的是 e3++4 OH-
e3++4 OH-

 2(SO4)3)
2(SO4)3)
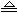 Fe2(SO4)3 + 3SO2↑+ 6H2O。
Fe2(SO4)3 + 3SO2↑+ 6H2O。
 (2)氯气进行自来水消毒时,起消毒杀菌作用的物质是 (写化学式),但用氯气消毒的水可能有臭味,长期饮用还可能对人造成潜在危害;ClO2是一种消毒杀菌效率高、二次污染小的水处理剂,工业上可用SO2与NaClO3溶液反应制得,该反应离子方程是 。
(2)氯气进行自来水消毒时,起消毒杀菌作用的物质是 (写化学式),但用氯气消毒的水可能有臭味,长期饮用还可能对人造成潜在危害;ClO2是一种消毒杀菌效率高、二次污染小的水处理剂,工业上可用SO2与NaClO3溶液反应制得,该反应离子方程是 。 4用于消毒杀菌,是利用其 性;实验室采用次氯酸盐氧化法制高铁酸钠,在次氯酸钠溶液中加入氢氧化钠和硫酸铁,可制备高铁酸钠的稀溶液,该反应的离子方程式是 。
4用于消毒杀菌,是利用其 性;实验室采用次氯酸盐氧化法制高铁酸钠,在次氯酸钠溶液中加入氢氧化钠和硫酸铁,可制备高铁酸钠的稀溶液,该反应的离子方程式是 。 大
大 值。
值。 .2mlO2后,可完全被H2O吸收,无气体剩余。则生成的NO为 ml;向反应后溶液加足量的NaOH溶液,得到沉淀的质量 g。(用含a的代数式表示)
.2mlO2后,可完全被H2O吸收,无气体剩余。则生成的NO为 ml;向反应后溶液加足量的NaOH溶液,得到沉淀的质量 g。(用含a的代数式表示) 12Na2CrO4+3Fe2O3 +7KCl+12H2O,
12Na2CrO4+3Fe2O3 +7KCl+12H2O,