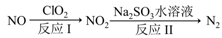适用年级:{{getGradeNameByProperty('高三|月考试卷|福建|2016年')}} 试卷类型:{{getTestPaperTypeName('高三|月考试卷|福建|2016年')}} 使用省份:{{getAreaName('高三|月考试卷|福建|2016年')}}
试卷年份:{{getYear('高三|月考试卷|福建|2016年')}} 上传日期:2016-04-13 题数:13
题号:3147693
题型:选择题
难易度:一般
日期:2016-04-13
来源:【百强校】2016届福建省福州一中高三下质检理综化学试卷(带解析)
【题文】下列说法不正确的是( )
A.将SO2 通入品红溶液,溶液褪色后加热恢复原色;将SO2 通入溴水,溴水褪色后加热也能恢复原色 B.乙酸乙酯的制备实验中,饱和Na2 CO3 溶液不仅可以降低乙酸乙酯的溶解度,还能吸收挥发出来的乙醇及乙酸 C.“中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,必须干燥或润洗后方可使用 D.除去干燥CO2 中混有的少量SO2 ,可将混合气体依次通过盛有酸性KMnO4 溶液、浓硫酸的洗气瓶
题号:3147694
题型:选择题
难易度:较易
日期:2016-04-13
来源:【百强校】2016届福建省福州一中高三下质检理综化学试卷(带解析)
【题文】除去NaHCO
3 溶液中混有的少量Na
2 CO
3 ,应采取最理想的方法是( )
A.加入稀盐酸 B.加入NaOH溶液 C.加入澄清石灰水 D.通入CO2
题号:3147695
题型:选择题
难易度:困难
日期:2016-04-13
来源:【百强校】2016届福建省福州一中高三下质检理综化学试卷(带解析)
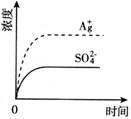
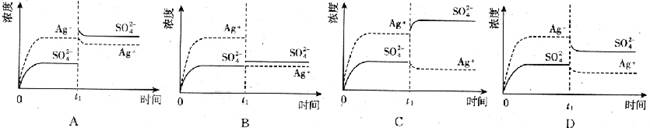
【题文】已知Ag
2 SO
4 的K
sp 为2.0×10
-5 mol
2 ·L
-2 ,将适量Ag
2 SO
4 固体溶于100 mL水中至刚好饱和,该过程中Ag
+ 和SO
4 2- 浓度随时间变化关系如下图(饱和Ag
2 SO
4 溶液中c(Ag
+ )=0.034mol·L
-1 )。若t
1 时刻在上述体系中加入100mL0.020mol·L
-1 Na
2 SO
4 溶液,下列示意图中,能正确表示t
1 时刻后Ag
+ 和SO
4 2- 浓度随时间变化关系的是( )
题号:3147716
题型:选择题
难易度:一般
日期:2016-04-13
来源:【百强校】2016届福建省福州一中高三下质检理综化学试卷(带解析)
【题文】X、Y、Z是三种短周期的主族元素,在周期表中的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )
A.气态氢化物的热稳定性:X > Z B.原子半径:X < Y < Z C.Y和Z的最高价氧化物对应水化物均为强酸 D.若Z的最高正价为+ m,则X的最高正价也一定为+ m
题号:3147717
题型:选择题
难易度:一般
日期:2016-04-13
来源:【百强校】2016届福建省福州一中高三下质检理综化学试卷(带解析)
【题文】下列说法正确的是( )
A.增大反应物浓度,可增大活化分子百分数,从而使有效碰撞次数增多 B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大 C.升高温度能使反应速率增大,主要原因是增加了反应物分子浓度 D.使用正催化剂能增大活化分子百分数,从而显著地增大化学反应速率
题号:3147718
题型:选择题
难易度:较难
日期:2016-04-13
来源:【百强校】2016届福建省福州一中高三下质检理综化学试卷(带解析)
【题文】若甲苯的苯环上有2个氢原子同时被1个羟基(—OH)和1个氯原子(—Cl)取代,则可形成的有机物同分异构体有( )
题号:4302399
题型:选择题
难易度:一般
日期:2016-04-13
来源:【百强校】2016届福建省福州一中高三下质检理综化学试卷(带解析)
【题文】我国有
丰富 的
海水资源 ,开发和利用
海水资源 是当前科学研究的一项重要任务。下列有关海水综合利用的说法不正确的是( )
A.从海水中 提炼出的氘 (含HDO 0.03‰)进行核聚变,放出巨大的能量以解决能源问题,成为一条新的科学思路,HDO与H2 O化学性质相同 B.从海水中提取镁可以采用下列方法:海水2 2 溶液→MgCl2 ·6H2 O2 (熔融) C.从海水获得的碘,可以跟氧气反应生成多种化合物,其中一种称为碘酸碘,在该化合物中,碘元素呈+3和+5两种价态,这种化合物的化学式是I4 O9 D.除去粗盐中的SO4 2 - 、Ca2+ 、Mg2+ 、Fe3+ 等杂质,加入的药品顺序为:Na2 CO3 溶液→NaOH溶液→BaCl2 溶液→过滤后加盐酸
题号:3147692
题型:实验题
难易度:困难
日期:2016-04-13
来源:【百强校】2016届福建省福州一中高三下质检理综化学试卷(带解析)
【题文】溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:
NaBr + H
2 SO
4 =NaHSO
4 + HBr
CH
3 CH
2 OH + HBr
CH
3 CH
2 Br + H
2 O
某课外小组欲在实验室制备溴乙烷的装置如右图。
数据如下表。
乙醇 溴乙烷 1, 2-二溴乙烷 乙醚 浓硫酸 密度/g·cm-3 0.79 1.46 2.2 0.71 1.84 熔点(℃) -130[ -119 9 -116 10 沸点(℃) 78.5 38.4 132 34.6 338 在水中的溶解度(g) 互溶 0.914 1 7.5 互溶
请回答下列问题。
(1)加入药品之前须做的操作是
。
(2)仪器B的作用是除了使溴乙烷馏出,还有一个目的是
。温度计的温度应控制在
;冷却水的流向应为
(填“D进E出”或“E进D出”)
(3)反应时有可能生成SO
2 和一种红棕色气体,可选择NaOH溶液分别除去这些气体,有关的离子方程式是______________、____________。
(4)实验中采用80%硫酸,而不能用98%浓硫酸,一方面是为了减少副反应(如避免HBr被氧化),另一方面是为了____________________。
题号:3147688
题型:填空题
难易度:较难
日期:2016-04-13
来源:【百强校】2016届福建省福州一中高三下质检理综化学试卷(带解析)
【题文】X、Y、Z、W、U五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57。Y原子的L层p轨道中有2个电子,Z的原子核外有三个未成对电子,W与Y原子的价电子数相同,U原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态。
(1)U
2+ 的外围电子排布式为
。
(2)X、Y、Z 可以形成化学式为XYZ的分子。该分子中各原子均达到稀有气体稳定结构,则该分子中Y采取的杂化轨道类型为
(3)比较Y和W的第一电离能,较大的是
(填元素符号),
(4)X与Z形成的最简单化合物Q的分子构型为
;U
2+ 与Q形成的配离子的离子反应方程式为
。
(5)U
+ 与Z
3- 形成的晶胞结构如图所示,阴、阳离子间的核间距为a cm。与同一个Z
3- 相连的U
+ 有
个,该晶体的密度为
g·cm
-3 。(设N
A 表示阿伏加德罗常数)
题号:3147689
题型:填空题
难易度:较难
日期:2016-04-13
来源:【百强校】2016届福建省福州一中高三下质检理综化学试卷(带解析)
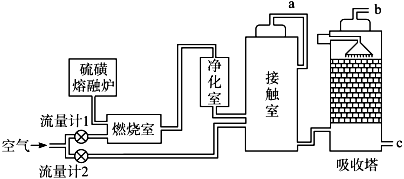
【题文】火山喷发所产生的硫磺可用于生产重要的化工原料硫酸。某企业用下图所示的工艺流程生产硫酸:
请回答下列问题:
(1)为充分利用反应放出的热量,接触室中应安装
(填设备名称);吸收塔中填充有许多瓷管,其作用是
;吸收塔不用水而用98.3%浓硫酸吸收SO
3 的原因是
。
(2)硫酸的用途非常广泛,可应用于下列哪些方面
。
A.橡胶的硫化 B.表面活性剂“烷基苯磺酸钠”的合成 C.铅蓄电池的生产 D.制备大量硫磺
(3)硫酸的各个生产环节中都有一些废渣、废液、废气产生,需要进行治理。由吸收塔排出的尾气中SO
2 的含量若超过500 μL·L
-1 ,就要加以处理处理才能排出。处理方法之一是用氨水洗涤烟气脱硫,所得产物可作为肥料。请写出此脱硫过程中可能发生的化学方程式:__________。
(4) 用含硫量为a%硫矿制硫酸,若燃烧时损失b%的硫元素,由SO
2 制SO
3 的转化率为c%。则制取1吨98%的硫酸需这种硫矿
吨(用代数式表达)
题号:3147690
题型:填空题
难易度:困难
日期:2016-04-13
来源:【百强校】2016届福建省福州一中高三下质检理综化学试卷(带解析)
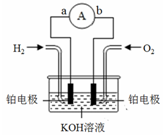
【题文】2015年CES消费电子展开幕前夕,丰田汽车公司宣布将会开放氢燃料电池技术专利的使用权,并正式发布量产型氢燃料电池轿车Mirai。氢氧燃料电池是符合绿色化学理念的新型发电装置。右图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。
(1)氢氧燃料电池的能量转化主要形式是
,在导线中电子流动方向为
(用a、b 和箭头表示)。
(2)负极反应式为
。
(3)电极表面镀铂粉的原因为
。
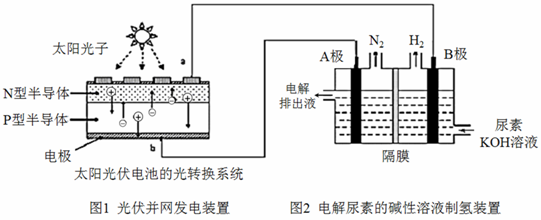
(4)氢气的制备和存储是氢氧燃料电池能否有效推广的关键技术。有人提出利用光伏发电装置电解尿素的碱性溶液来制备氢气。光伏发电是当今世界利用太阳能最主要方式之一。图1为光伏并网发电装置,图2为电解尿素[CO(NH
2 )
2 ](C为+4价)的碱性溶液制氢的装置示意图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。
① 图1中N型半导体为
(填“正极”或“负极”)
② 该系统工作时,A极的电极反应式为
③ 若A极产生7.00g N
2 ,则此时B极产生
L H
2 (标况下)。
题号:3147691
题型:填空题
难易度:较难
日期:2016-04-13
来源:【百强校】2016届福建省福州一中高三下质检理综化学试卷(带解析)
【题文】据统计,2015年入冬以来,华北黄淮地区已经出现4次严重雾霾过程,持续时间达3~7天。氮氧化物是造成雾霾天气的主要原因之一,消除氮氧化物有多种方法。
(1)NH
3 催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。发生的化学反应是:2NH
3 (g) + NO(g) + NO
2 (g)
2N
2 (g) + 3H
2 O(g) ΔH < 0。
① 当该反应有1mol N
2 (g)生成时,电子转移总数是
② 该反应的平衡表达式K=
③ 为了加快反应反应速率,并且提高NO
x 的转化率,采取的措施是_______(填字母)。
a.增大NH
3 的浓度 b.增大N
2 的浓度 c.增大压强 d.选择合适的催化剂
(2)可利用甲烷催化还原氮氧化物。已知:
CH
4 (g) + 4NO
2 (g)="4NO(g)" + CO
2 (g) + 2H
2 O(g) ΔH =" -" 574 kJ·mo
-1 CH
4 (g) + 2NO
2 (g)=N
2 (g) + CO
2 (g) + 2H
2 O(g) ΔH =" -" 867 kJ·mo
-1 则CH
4 (g)将NO(g)还原为N
2 (g)的热化学方程式是
。
(3)利用ClO
2 消除氮氧化物的污染,反应过程如下:(部分反应物或生成物略去)
反应Ⅰ的产物中还有两种强酸生成,且其中一种强酸硝酸与NO
2 的物质的量相等,则化学方程式是
,若有11.2 L N
2 生成(标准状况),共消耗ClO
2 g 。
题号:3147687
题型:推断题
难易度:较难
日期:2016-04-13
来源:【百强校】2016届福建省福州一中高三下质检理综化学试卷(带解析)
【题文】化合物H是重要的有机物,可由E和F在一定条件下合成:(部分反应物或产物省略,另请注意箭头的指向方向)
已知以下信息:
i.A属于芳香烃,H属于酯类化合物。
ii.I的核磁共振氢谱为二组峰,且峰的面积比为6:1。
回答下列问题:
(1)D的含氧官能团名称
,B的结构简式
。
(2)B → C和G → J两步的反应类型
,
。
(3)① E + F → H的化学方程式
。
② I → G 的化学方程式
。
(4)H的同系物K比H相对分子质量小28,K有多种同分异构体。
①K的一种同分异构体能发生银镜反应,也能使FeCl
3 溶液显紫色,苯环上有两个支链,苯环上的氢的核磁共振氢谱为二组峰,且峰面积比为1:1,写出K的这种同分异构体的结构简式
。
②若K的同分异构体既属于芳香族化合物,又能和饱和NaHCO
3 溶液反应放出CO
2 。则满足该条件的同分异构体共有__________种(不考虑立体异构)。

 Mg(OH)2
Mg(OH)2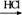 MgCl2溶液→MgCl2·6H2O
MgCl2溶液→MgCl2·6H2O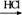 MgCl2 (熔融)
MgCl2 (熔融) Mg[
Mg[ CH3CH2Br + H2O
CH3CH2Br + H2O
 物质
物质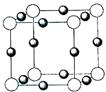
 2N2(g) + 3H2O(g) ΔH < 0。
2N2(g) + 3H2O(g) ΔH < 0。