适用年级:{{getGradeNameByProperty('高三|月考试卷|福建|2015年')}} 试卷类型:{{getTestPaperTypeName('高三|月考试卷|福建|2015年')}} 使用省份:{{getAreaName('高三|月考试卷|福建|2015年')}}
试卷年份:{{getYear('高三|月考试卷|福建|2015年')}}上传日期:2016-01-15题数:22
提示:单击题文可显示答案与解析。
题号:3176129
题型:选择题
难易度:一般
日期:2016-01-15
来源:【百强校】2016届福建省厦门一中高三上12月月考化学试卷(带解析)
【题文】浙江大学成功研制出能在数分钟之内将电量充满的锂电池,其成本只有传统锂电池的一半。若电解液为LiAlCl
4-SOCl
2,电池的总反应为:4Li+2SOCl
2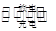
4LiCl+S+SO
2。下列说法正确的是:
| A.充电时阳极反应式为:4Cl-+S+SO2-4e-=2SOCl2 |
| B.电池的电解液可用LiCl水溶液代替 |
| C.放电时电子从负极经电解液流向正极 |
| D.该电池放电时,负极发生还原反应 |
题号:3176130
题型:选择题
难易度:较难
日期:2016-01-15
来源:【百强校】2016届福建省厦门一中高三上12月月考化学试卷(带解析)
【题文】已知某温度下,K
sp(AgCl)=1.56×10
-10,K
sp(Ag
2CrO
4)=1×10
-12。下列关于该温度下的叙述正确的是:
| A.向氯化银的悬浊液中加入氯化钠溶液,Ksp(AgCl) 减小 |
| B.饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大 |
| C.若向0.0008 mol·L-1的K2CrO4溶液中加入等体积0.002 mol·L-1的AgNO3溶液,则CrO42-完全沉淀(提示:沉淀完全c(CrO42-)≤10-5 mol·L-1) |
| D.若将0.001 mol·L-1 AgNO3溶液滴入浓度均为0.001 mol·L-1的KCl和K2CrO4混合溶液中,则先产生AgCl沉淀 |
题号:3176131
题型:选择题
难易度:一般
日期:2016-01-15
来源:【百强校】2016届福建省厦门一中高三上12月月考化学试卷(带解析)
【题文】pH=2的A、B两种酸溶液各1mL,分别加水稀释到1L(其pH与溶液体积V的关系如右图)。下列说法正确的是
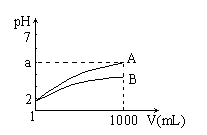
①a=5时,A是强酸,B是弱酸
②若A、B都是弱酸,则 5>a>2
③稀释后,A酸溶液的酸性比B酸溶液的酸性强
④A、B两种酸溶液的物质的量浓度一定相等
A.①② B.③④ C.①③ D.②④
题号:3176132
题型:选择题
难易度:较难
日期:2016-01-15
来源:【百强校】2016届福建省厦门一中高三上12月月考化学试卷(带解析)
【题文】现有物质的量浓度均为 0.1 mol·L
- 1 的四种溶液各25mL:①氨水 ②NH
4Cl 溶液
③Na
2CO
3溶液 ④NaHCO
3溶液,下列说法正确的是:
| A.4种溶液pH的大小顺序:①>④>③>② |
| B.①、②混合后pH>7,则混合溶液中c(NH4+)<c(NH3·H2O) |
| C.①、②中分别加入25mL 0.1 mol·L – 1盐酸后,溶液中c(NH4+):①>② |
| D.③、④中分别加入12.5mL 0.1 mol·L – 1NaOH溶液后,两溶液中离子种类相同 |
题号:3176133
题型:选择题
难易度:较难
日期:2016-01-15
来源:【百强校】2016届福建省厦门一中高三上12月月考化学试卷(带解析)
【题文】下列溶液中粒子的物质的量浓度关系正确的是:
A.0.1 mol·L - 1 NaHC2O4溶液与0.1 mol·L – 1KOH溶液等体积混合,所得溶液中:
c(Na+)>c(K+) >c(C2O42-) >c(OH-) >c(HC2O4-) |
| B.20mL 0.1 mol·L - 1NH4Cl溶液与10mL 0.1 mol·L - 1NaOH溶液混合后溶液呈碱性,所得溶液中:c(Cl-)>c(NH4+) >c(Na+)>c(OH-)>c(H+) |
C.常温下,pH=2的HF溶液与pH=12的氢氧化钠溶液等体积混合,所得溶液中:
c(Na+)+ c(OH-) >c(H+)+ c(F-) |
| D.0.1 mol·L – 1 NH3·H2O溶液与0.1 mol·L – 1 HNO3溶液等体积混合,所得溶液中: |
c(H
+) >c(OH
-) + c(NH
3·H
2O)
题号:3176134
题型:选择题
难易度:一般
日期:2016-01-15
来源:【百强校】2016届福建省厦门一中高三上12月月考化学试卷(带解析)
【题文】对下列各溶液进行电解,通电一段时间后,溶液颜色不会发生显著改变的是:
| A.以铜为电极,电解1 mol·L-1H2SO4溶液 |
| B.以石墨为电极,电解1 mol·L-1KBr溶液 |
| C.以石墨为电极,电解含酚酞的饱和食盐水 |
| D.以铜为电极,电解CuSO4溶液 |
题号:3176135
题型:选择题
难易度:较难
日期:2016-01-15
来源:【百强校】2016届福建省厦门一中高三上12月月考化学试卷(带解析)
【题文】将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s)
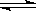
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示,已知K
p是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,下列说法正确的是:

| A.b>f |
| B.平衡常数K(1000℃)<K(810℃) |
| C.915℃、2.0MPa该反应的平衡常数为Kp=4.5MPa |
| D.1000℃、3.0MPa时E的转化率为83% |
题号:3176136
题型:选择题
难易度:一般
日期:2016-01-15
来源:【百强校】2016届福建省厦门一中高三上12月月考化学试卷(带解析)
【题文】在一定温度下,将气体X和气体Y各0. 16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g)
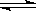
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min
| 2
| 4
| 7
| 9
|
n(Y)/mol
| 0.12
| 0.11
| 0.10
| 0.10
|
下列说法正确的是
A.0~2 min的平均速率v(Z)=2.0×10
-3 mol·L
-1·min
-1B.其他条件不变,降低温度,反应达到新平衡时v(正)< v(逆)
C.该温度下此反应的平衡常数K=144
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数不变
题号:3176137
题型:选择题
难易度:较难
日期:2016-01-15
来源:【百强校】2016届福建省厦门一中高三上12月月考化学试卷(带解析)
【题文】下列图示与对应的叙述相符的是
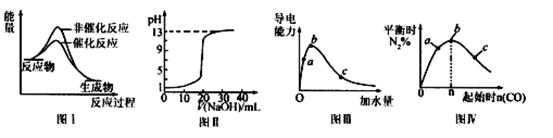
| A.图I表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B.图Ⅱ表示常温下,0. 100 mol/L NaOH溶液滴定20. 00 mL、0.100 mol/L HC1溶液所得到的滴定曲线 |
| C.图Ⅲ表示一定质量的冰醋酸加水稀释过程中,醋酸溶液电离程度:c<a<b |
D.图Ⅳ表示反应4CO(g)+2NO2(g)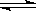 N2(g)+4CO2(g),在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知的转化率c>b>a N2(g)+4CO2(g),在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知的转化率c>b>a |
题号:3176138
题型:选择题
难易度:一般
日期:2016-01-15
来源:【百强校】2016届福建省厦门一中高三上12月月考化学试卷(带解析)
【题文】X、Y、Z、W有如图所示的转化关系,则X、Y可能是
①C、CO ②S、SO
2 ③AlCl
3、Al(OH)
3 ④Cl
2、FeCl
3A.仅有①③ B.①②③ C.仅有②④ D.①②③④
题号:3176139
题型:选择题
难易度:较难
日期:2016-01-15
来源:【百强校】2016届福建省厦门一中高三上12月月考化学试卷(带解析)
【题文】设N
A为阿伏伽德罗常数的值。下列说法正确的是:
| A.0.2 mol Al与足量NaOH溶液反应,生成的H2体积为6.72L |
| B.常温下pH=1的盐酸溶液中的H+离子数目为0.1NA |
| C.铅蓄电池中,当正极增加9.6g时,电路中通过的电子数目为0.3NA |
| D.11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4反应中,6 mol CuSO4能氧化白磷的分子数为1.1NA |
题号:3176140
题型:选择题
难易度:一般
日期:2016-01-15
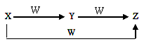
来源:【百强校】2016届福建省厦门一中高三上12月月考化学试卷(带解析)
【题文】用下列实验装置进行相应实验,能达到实验目的是:
题号:3176141
题型:选择题
难易度:一般
日期:2016-01-15
来源:【百强校】2016届福建省厦门一中高三上12月月考化学试卷(带解析)
【题文】用下列实验装置进行相应实验,装置正确且能达到实验目的是:
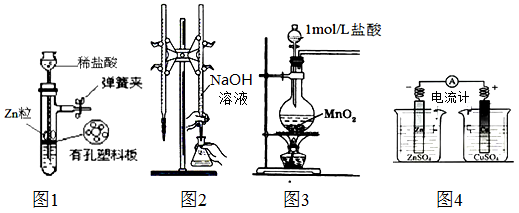
| A.用图1所示装置制取少量H2 |
| B.用图2所示装置用标准浓度的氢氧化钠溶液测定盐酸的浓度 |
| C.用图3所示装置制取少量Cl2 |
| D.用图4所示装置确定导线中有电流通过并确定电流方向 |
题号:3176142
题型:选择题
难易度:一般
日期:2016-01-15
来源:【百强校】2016届福建省厦门一中高三上12月月考化学试卷(带解析)
【题文】下列实验方案设计中,能达到实验目的的是:
选项
| 实验目的
| 实验方案
|
A
| 验证二氧化硫漂白性
| 二氧化硫通入溴水中,看溶液颜色是否褪色
|
B
| 检验氯化铁溶液中是否含FeCl2
| 向氯化铁溶液中滴加氢氧化钠溶液
|
C
| 检验食盐中是否添加KIO3
| 取食盐试样,溶于KI溶液,加入淀粉溶液,观察溶液是否变蓝
|
D
| 验证Ksp(AgI)>Ksp(AgCl)
| 向含等物质的量NaCl、KI的混合液中滴加AgNO3溶液,观察沉淀颜色
|
题号:3176143
题型:选择题
难易度:一般
日期:2016-01-15
来源:【百强校】2016届福建省厦门一中高三上12月月考化学试卷(带解析)
【题文】下列关于右图所示转化关系(X代表卤素)的说法错误的是:
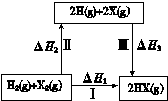
| A.2H(g) +2X(g) = 2HX(g)ΔH3<0 |
| B.ΔH1 = ΔH2 + ΔH3 |
| C.Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量按Cl、Br、I的顺序依次增多 |
| D.途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定 |
题号:3176144
题型:选择题
难易度:较难
日期:2016-01-15
来源:【百强校】2016届福建省厦门一中高三上12月月考化学试卷(带解析)
【题文】下列各组离子在指定溶液中可能大量共存的是
①无色透明溶液中:K
+、Ca
2+、MnO
4-、SO
42-②pH=11的溶液中:CO
32-、Na
+、 [Al(OH)]
4-、NO
3-③加入Al能放出H
2的溶液中:Cl
-、HCO
3-、SO
42-、NH
4+④由水电离出的c(OH
-) =10
-4mol·L
-1的溶液中:NH
4+、Al
3+、Cl
-、Br
-⑤有较多Fe
3+的溶液中:Na
+、NH
4+、SCN
-、Cl
-⑥酸性溶液中:Fe
2+、Al
3+、NO
3-、I
-、Cl
-
题号:3176145
题型:选择题
难易度:容易
日期:2016-01-15
来源:【百强校】2016届福建省厦门一中高三上12月月考化学试卷(带解析)
【题文】化学与生产生活密切相关,下列说法正确的是
| A.碳酸钡可用于制治疗胃酸过多的药 |
| B.二氧化硫可用作食品的漂白剂 |
| C.碳纤维是复合材料 |
| D.PM2.5指数是雾霾天气监测中的重要指标 |
题号:4303311
题型:选择题
难易度:较难
日期:2016-01-15
来源:【百强校】2016届福建省厦门一中高三上12月月考化学试卷(带解析)
【题文】某一元弱酸HA的相对分子质量为M。在t℃时,将ag HA完全溶解于水中,得V mL饱和溶液,测得该溶液的密度为ρ g/cm3,其中溶液pH=b。下列叙述中,错误的是
A.t℃时,HA的Ka=10-2b/1000a/MV
B.物质的量浓度:c(HA)=1000a/MV mol·L-1
C.t℃时,HA的溶解度:S=100a/ρV g
D.HA的质量分数:ω(HA)=(a/ρV)×100%
题号:3176127
题型:实验题
难易度:较难
日期:2016-01-15
来源:【百强校】2016届福建省厦门一中高三上12月月考化学试卷(带解析)
【题文】实验室制备硝基苯的反应原理和实验装置如下:
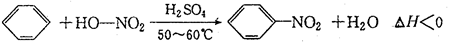
存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯。
有关数据列如下表:

实验步骤如下:
取100mL烧杯,用20 mL浓硫酸与18 mL浓硝酸配制混和酸,将混合酸小心加入B中。把18 mL(15.84 g)苯加入A中。向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀。在50~60℃下发生反应,直至反应结束。
将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5%NaOH溶液和水洗涤。分出的产物加入无水CaCl
2颗粒,静置片刻,弃去CaCl
2,进行蒸馏纯化,收集205~210℃馏分,得到纯硝基苯18g。
回答下列问题:
(1)装置B的名称是___________。装置C的作用是_____________。
(2)配制混合酸时,能否将浓硝酸加入到浓硫酸中,说明理由:________________。
(3)为了使反应在50℃~60℃下进行,常用的方法是______________________。
(4)在洗涤操作中,第二次水洗的作用是__________________________。
(5)在蒸馏纯化过程中,因硝基苯的沸点高于140℃,应选用空气冷凝管,不选用直形冷凝管的原因是_______________________。
(6)本实验所得到的硝基苯产率是______________________。
题号:3176125
题型:填空题
难易度:较难
日期:2016-01-15
来源:【百强校】2016届福建省厦门一中高三上12月月考化学试卷(带解析)
【题文】(1)将1.8g碳置于2.24L(标准状况)O
2中充分燃烧,至全部反应物耗尽,测得放出热量30.65kJ,已知:C(s)+O
2(g)
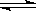
CO
2(g) △H=-393.0 kJ·mol
—1,请写出CO完全燃烧的热化学方程式
。
(2)光气 (COCl
2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl
2(g)+CO(g)
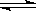
COCl
2(g) △H<0制备。右图为某次模拟实验研究过程中容积为1L的密闭容器内各物质的浓度随时间变化的曲线。回答下列问题:
①若保持温度不变,在第8min 加入体系中的三种物质各1mol,则平衡
移动(填“向正反应方向”、“向逆反应方向”或“不”);
②若将初始投料浓度变为c(Cl
2)=0.8mol/L、c(CO)=0.6 mol/L、c(COCl
2)=
mol/L,保持反应温度不变,则最终达到化学平衡时,Cl
2的体积分数与上述第6 min时Cl
2的体积分数相同;
③比较第8 min反应温度T(8)与第15 min反应温度T(15)的高低:T(8)
T(15)(填“<”、“>”或“=”)。
(3)将燃煤废气中的CO
2转化为二甲醚的反应原理为:
2CO
2(g) + 6H
2(g)

CH
3OCH
3(g) + 3H
2O(g)。
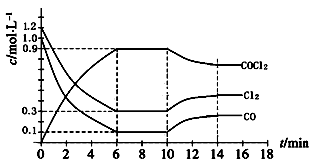
①已知一定条件下,该反应中CO
2的平衡转化率随温度、投料比[n(H
2) / n(CO
2)]的变化曲线如图:在其他条件不变时,请在右图中画出平衡时CH
3OCH
3的体积分数随投料比[n(H
2) / n(CO
2)]变化的曲线图。
②二甲醚(CH
3OCH
3)燃料电池可以提升能量利用率,二甲醚酸性介质燃料电池的负极反应式为
。
(4)常温下,将a mol/L的醋酸与b mol/L Ba(OH)
2溶液等体积混合,充分反应后,溶液中存在2c(Ba
2+)=c(CH
3COO
-),则该混合溶液中醋酸的电离常数Ka=
(用含和的代数式表示)。
题号:3176126
题型:填空题
难易度:较难
日期:2016-01-15
来源:【百强校】2016届福建省厦门一中高三上12月月考化学试卷(带解析)
【题文】一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co
2O
3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中回收氧化钴(CoO)的工艺流程如图所示:
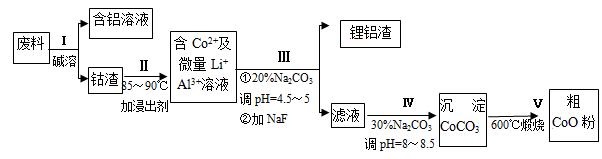
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为
。
(2)过程Ⅱ中加入稀H
2SO
4酸化后,再加入Na
2S
2O
3溶液浸出钴。则浸出钴的化学反应方程式为(产物中只有一种酸根)
。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因
。
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)
3,碳酸钠溶液在产生Al(OH)
3时起重要作用,请写出该反应的离子方程式
。
(4)碳酸钠溶液在过程Ⅲ和Ⅳ中所起作用有所不同,请写出在过程IV中起的作用是_____________。
(5)在Na
2CO
3溶液中存在多种粒子,下列各粒子浓度关系正确的是____________(填序号)。
| A.c(Na+) = 2c(CO32-) | B.c(Na+) > c(CO32-) > c(HCO3-) |
| C.c(OH-) > c(HCO3-) > c(H+) | D.c(OH-)-c(H+) = c(HCO3-) + 2c(H2CO3) |
(6)CoO溶于盐酸可得粉红色的CoCl
2溶液。CoCl
2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl
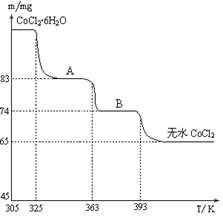
2吸水变色这一性质可制成变色水泥和显隐墨水。下图是粉红色的CoCl
2·6H
2O晶体受热分解时,剩余固体质量随温度变化的曲线,A物质的化学式是____________。
题号:3176128
题型:推断题
难易度:较难
日期:2016-01-15
来源:【百强校】2016届福建省厦门一中高三上12月月考化学试卷(带解析)
【题文】X、Y、Z三种短周期元素,其中X元素的原子序数大于Y,且X、Y的氧化物都是形成酸雨的主要物质。Z是地壳中含量最高的金属元素;而地壳中含量最高的非金属元素与X同主族、与Y同周期。
(1)实验室用H
2XO
4制取XO
2气体的化学反应方程式为
。(请用具体元素符号表示化学式,下同)
(2)t℃时,0.1 mol·L
-1的NaHXO
3溶液pH=6,该溶液中各离子浓度由大到小顺序排列为
。
(3)请写出Z的氧化物与烧碱溶液反应的离子方程式
。
(4)一定条件下,YO与YO
2存在下列反应:YO(g)+ YO
2(g)
Y
2O
3(g),其平衡常数表达式为K=
。
(5)工业上用氧化YH
3法制取YO,该反应的热化学方程式为:
4YH
3(g)+5O
2(g)=4YO(g)+6H
2O(g) △H="-905.8" kJ·mol
-1;
已知Y
2(g)+O
2(g)="2YO(g)" △H="+180" kJ·mol
-1,则YH
3与氧气反应产生两种无污染物质的热化学式为
。
(6)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。
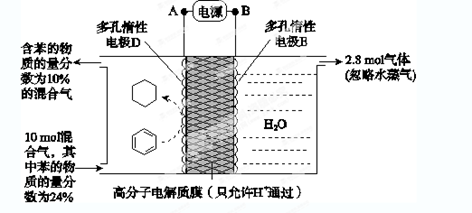
①导线中电子移动方向为________。(用A、D表示)
②生成目标产物的电极反应式为__________________。
③该储氢装置的电流效率η=____________________。
(η=

×100%,计算结果保留小数点后1位)
 4LiCl+S+SO2。下列说法正确的是:
4LiCl+S+SO2。下列说法正确的是:
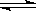 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示,已知Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,下列说法正确的是:
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示,已知Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,下列说法正确的是:
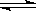 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
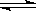 N2(g)+4CO2(g),在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知的转化率c>b>a
N2(g)+4CO2(g),在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知的转化率c>b>a



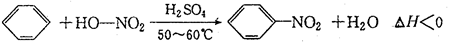

 CO2(g) △H=-393.0 kJ·mol—1,请写出CO完全燃烧的热化学方程式 。
CO2(g) △H=-393.0 kJ·mol—1,请写出CO完全燃烧的热化学方程式 。 COCl2(g) △H<0制备。右图为某次模拟实验研究过程中容积为1L的密闭容器内各物质的浓度随时间变化的曲线。回答下列问题:
COCl2(g) △H<0制备。右图为某次模拟实验研究过程中容积为1L的密闭容器内各物质的浓度随时间变化的曲线。回答下列问题:
 CH3OCH3(g) + 3H2O(g)。
CH3OCH3(g) + 3H2O(g)。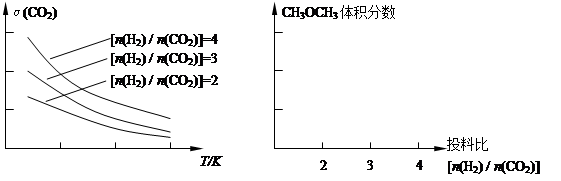


 Y2O3(g),其平衡常数表达式为K= 。
Y2O3(g),其平衡常数表达式为K= 。
 ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)