适用年级:{{getGradeNameByProperty('高二|月考试卷|福建|2015年')}} 试卷类型:{{getTestPaperTypeName('高二|月考试卷|福建|2015年')}} 使用省份:{{getAreaName('高二|月考试卷|福建|2015年')}}
试卷年份:{{getYear('高二|月考试卷|福建|2015年')}}上传日期:2016-01-04题数:20
提示:单击题文可显示答案与解析。
题号:3187849
题型:选择题
难易度:一般
日期:2016-01-04
来源:2015-2016学年福建省四地六校高二上学期11月联考化学试卷(带解析)
【题文】电解硫酸钠溶液生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1∶2,以下说法正确的是( )

| A.a极与电源的负极相连 |
| B.a电极反应式:2H2O+2e-= H2↑+2OH- |
| C.离子交换膜d为阴离子交换膜 |
| D.产物丙为硫酸溶液 |
题号:3187850
题型:选择题
难易度:一般
日期:2016-01-04
来源:2015-2016学年福建省四地六校高二上学期11月联考化学试卷(带解析)
【题文】已知反应2P(g)+Q(g)

xW(g)+U(g),某温度下,将等物质的量的P与Q投入体积固定2L密闭容器中,经5min后到达平衡,5min内W的平均反应速率是0.2 mol·L
-1•min
-1,平衡时U的浓度为0.5 mol·L
-1,[P]:[Q]=1:2,下列说法错误的是
| A.x值是2 |
| B.P平衡转化率为66.7% |
| C.平衡常数为1 |
| D.反应前,Q的物质的量为3 mol |
题号:3187851
题型:选择题
难易度:较易
日期:2016-01-04
来源:2015-2016学年福建省四地六校高二上学期11月联考化学试卷(带解析)
【题文】298K时,在FeCl
3酸性溶液中加少量锌粒后,Fe
3+立即被还原成Fe
2+。据此某学习小组设计如图所示的原电池装置。下列有关说法正确的是

| A.正极反应为:Zn – 2e-→Zn2+ |
| B.盐桥中K+向右池移动 |
| C.Pt电极上有气泡出现 |
| D.左烧杯中溶液的红色变浅 |
题号:3187852
题型:选择题
难易度:一般
日期:2016-01-04
来源:2015-2016学年福建省四地六校高二上学期11月联考化学试卷(带解析)
【题文】在一密闭容器中,反应aA(g)

bB(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度变为原来的60%,则
| A.平衡逆向移动了 |
| B.物质A的转化率减小了 |
| C.物质B的质量分数增大了 |
| D.反应速率增大,且v正 > v逆 |
题号:3187853
题型:选择题
难易度:一般
日期:2016-01-04
来源:2015-2016学年福建省四地六校高二上学期11月联考化学试卷(带解析)
【题文】对于可逆反应mA(g)+nB(s)

pC(g)+ qD(g)反应过程中,其他条件不变时,D的百分含量与温度(T)或压强(P)关系如图所示,反应达平衡后,下列叙述正确的是

| A.升高温度,平衡正移 |
| B.使用催化剂,D的百分含量增加 |
| C.m<p+q |
| D.B的颗粒越小,反应速率越快,有利于平衡向正反应方向移动 |
题号:3187854
题型:选择题
难易度:一般
日期:2016-01-04
来源:2015-2016学年福建省四地六校高二上学期11月联考化学试卷(带解析)
【题文】甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH
3OH(g)+H
2O(g)=CO
2(g)+3H
2(g); △H
1=" +" 49.0 kJ·mol
-1②CH
3OH(g)+1/2O
2(g)=CO
2(g)+2H
2(g);△H
2=-192.9 kJ·mol
-1下列说法正确的是
| A.CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) 的焓变△H = 3△H2 + 2△H1 |
B.应①中的能量变化如图所示
 |
| C.CH3OH转变成H2的过程一定要吸收能量 |
| D.根据②推知反应:CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ·mol-1 |
题号:3187855
题型:选择题
难易度:一般
日期:2016-01-04
来源:2015-2016学年福建省四地六校高二上学期11月联考化学试卷(带解析)
【题文】NH
4HS(s)

NH
3(g)+H
2S(g)在一定温度下达到平衡,下列情况不能使平衡发生移动的是
| A.温度、容积不变,充入NH3 |
| B.温度、容积不变时,充入SO2气体 |
| C.充入N2,保持压强不变 |
| D.移走一部分NH4HS固体 |
题号:3187856
题型:选择题
难易度:一般
日期:2016-01-04
来源:2015-2016学年福建省四地六校高二上学期11月联考化学试卷(带解析)
【题文】铅蓄电池的充、放电反应方程式为:Pb+PbO
2+2H
2SO
4 
2PbSO
4+2H
2O。
关于铅蓄电池的说法正确的是
| A.放电时,正极发生的反应是:Pb(s)+SO42--2e-===PbSO4(s) |
| B.充电时,每消耗1 mol PbSO4的同时转移2mol 电子 |
| C.放电时,该电池的负极材料是铅板 |
| D.充电时,电池中硫酸的浓度不断变小 |
题号:3187857
题型:选择题
难易度:一般
日期:2016-01-04
来源:2015-2016学年福建省四地六校高二上学期11月联考化学试卷(带解析)
【题文】下列与金属腐蚀有关的说法,正确的是

| A.图1中,插入海水中的铁棒,越靠近底端腐蚀越严重 |
| B.图2中,发生吸氧腐蚀 |
| C.图3中,燃烧灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀 |
| D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁相当于原电池的正极 |
题号:3187858
题型:选择题
难易度:一般
日期:2016-01-04
来源:2015-2016学年福建省四地六校高二上学期11月联考化学试卷(带解析)
【题文】用CaCO
3与1 mol·L
-1稀盐酸反应制取CO
2,下列措施对反应速率几乎没影响的是
| A.改用浓度为0.5 mol·L-1的稀硫酸 |
| B.加入更多的碳酸钙 |
| C.稍微加热,升高反应温度 |
| D.改用浓度为2 mol·L-1的稀盐酸 |
题号:3187859
题型:选择题
难易度:较易
日期:2016-01-04
来源:2015-2016学年福建省四地六校高二上学期11月联考化学试卷(带解析)
【题文】下列描述中,不符合生产实际的是
| A.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极 |
| B.电解法精炼粗铜,用纯铜作阴极 |
| C.电解熔融的氧化铝制取金属铝,用铁作阳极 |
| D.在镀件上电镀锌,用锌作阳极 |
题号:3187860
题型:选择题
难易度:一般
日期:2016-01-04
来源:2015-2016学年福建省四地六校高二上学期11月联考化学试卷(带解析)
【题文】如图所示,利用2Ag + Cl
2 = 2AgCl设计的原电池可测量空气中Cl
2的含量(原电池的电解质是含有自由移动Ag
+的固体物质)。下列分析不正确的是

| A.空气中c(Cl2)越大,Ag极消耗速率越快 |
| B.Ag+向Pt电极移动 |
| C.电子由Ag电极经外电路流向Pt电极 |
| D.Ag电极上发生了还原反应 |
题号:3187861
题型:选择题
难易度:一般
日期:2016-01-04
来源:2015-2016学年福建省四地六校高二上学期11月联考化学试卷(带解析)
【题文】已知I
2(g)+H
2(g)

2HI(g)△H=-QkJ/mol(Q>0),H-H键能为akJ/mol,H-I键能为bkJ/mol,则I-I键能是
| A.b+Q-a kJ/mol |
| B.2b-Q-a kJ/mol |
| C.2b+Q-a kJ/mol |
| D.b-Q+a kJ/mol |
题号:3187862
题型:选择题
难易度:较易
日期:2016-01-04
来源:2015-2016学年福建省四地六校高二上学期11月联考化学试卷(带解析)
【题文】反应3A(g)+B(g)

2C(g)+2D(g),在不同情况下测得反应速率如下,其中反应速率最快的是
A.v(A)=1.5 mol·L
-1·s
-1B.v(C)=0.5 mol·L
-1·s
-1C.v(D)=0.6 mol·L
-1·s
-1D.v(B)=0.4 mol·L
-1·s
-1
题号:3187863
题型:选择题
难易度:较易
日期:2016-01-04
来源:2015-2016学年福建省四地六校高二上学期11月联考化学试卷(带解析)
【题文】下列有关说法不正确的是
| A.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 |
| B.手机上用的锂离子电池属于二次电池 |
| C.燃料电池能把化学能转化成电能 |
| D.已知反应2CO(g)=2C(s)+O2(g)的△H>0、△S<0,那么高温下可自发进行 |
题号:4304213
题型:选择题
难易度:一般
日期:2016-01-04
来源:2015-2016学年福建省四地六校高二上学期11月联考化学试卷(带解析)
【题文】某学习小组为了探究 BrO
3-+ 5Br
-+ 6H
+ = 3Br
2 + 3H
2O 反应速率(v)与反应物浓度的关系,在20℃进行实验,所得的数据如下表,下列结论不正确的是
实验编号
相关数据
| ①
| ②
| ③
| ④
| ⑤
|
c(H+)/ mol · L-1
| 0.008
| 0.008
| 0.004
| 0.008
| 0.004
|
c(BrO3-)/ mol· L-1
| 0.001
| 0.001
| 0.001
| 0.002
| 0.002
|
c(Br-)/ mol· L-1
| 0.10
| 0.20
| 0.20
| 0.10
| 0.40
|
v / mol· L-1· s-1
| 2.4×10-8
| 4.8×10-8
| 1.2×10-8
| 4. 8×10-8
| v1
|
A.若温度升高到40℃,则反应速率增大
B.实验②、④,探究的是c(BrO
3-)对反应速率的影响
C.若该反应速率方程为v =" k" c
a(BrO
3-)c
b(Br
-)c
c(H
+)(k为常数),则c = 2
D.实验⑤中,v
1 = 4.8×10
-8 mol· L
-1· s
-1
题号:3187847
题型:实验题
难易度:一般
日期:2016-01-04
来源:2015-2016学年福建省四地六校高二上学期11月联考化学试卷(带解析)
【题文】甲、乙两个小组利用酸性KMnO
4与H
2C
2O
4溶液反应,设计实验探究影响反应速率的因素(2MnO
4- + 5H
2C
2O
4+ 6H
+=2Mn
2+ +10CO
2+8H
2O)
甲组:利用右图装置,通过测定单位时间内生成CO
2气体体积的大小来比较化学反应速率的大小。(实验中所用KMnO
4溶液均已加入H
2SO
4)

序号
| A溶液
| B溶液
|
①
| 2ml 0.2mol/LH2C2O4溶液
| 4ml 0.01mol/LKMnO4溶液
|
②
| 2ml 0.1mol/LH2C2O4溶液
| 4ml 0.01mol/LKMnO4溶液
|
③
| 2ml 0.2mol/LH2C2O4溶液
| 4ml 0.01mol/LKMnO4溶液和少量MnSO4
|
(1)该实验的目的是探究
对化学反应速率的影响。
(2)分液漏斗中A溶液应该
加入(填“一次性”或“逐滴滴加”)
(3)实验结束后,读数前为了使两个量气管的压强相等,避免产生压强差,影响测定结果,需要进行的操作是
。
乙组:通过测定KMnO
4溶液褪色所需时间的多少来比较化学反应速率
为了探究KMnO
4与H
2C
2O
4浓度对反应速率的影响,某同学在室温下完成以下实验
实验编号
| 1
| 2
| 3
| 4
|
水/ml
| 10
| 5
| 0
| X
|
0.5 mol/L H2C2O4/ml
| 5
| 10
| 10
| 5
|
0.2 mol/L KMnO4/ml
| 5
| 5
| 10
| 10
|
时间/s
| 40
| 20
| 10
| ---
|
(4)X=
A.5 B.10 C.15 D.20
4号实验中始终没有观察到溶液褪色,你认为可能的原因是
。
题号:3187846
题型:填空题
难易度:较难
日期:2016-01-04
来源:2015-2016学年福建省四地六校高二上学期11月联考化学试卷(带解析)
【题文】某同学设计了一个甲醇(CH
3OH)燃料电池,并用该电池电解200mL一定浓度NaCl与CuSO
4混合溶液,其装置如图1:

(1)25℃,1.01×10
5Pa时16g液态甲醇完全燃烧,当恢复至原状态时,放出362.9kJ热量,此反应的热化学方程式为
。
(2)写出甲中通入甲醇这一极的电极反应式
。
(3)铁电极上反应的现象为:先有红色的物质析出,后
。
石墨电极上产生的气体是
。
(4)理论上乙中两极所得气体的体积随时间变化的关系如图2所示(气体体积已换算成标准状况下的体积)原混合溶液中CuSO
4的物质的量浓度
mol·L
-1。(假设溶液体积不变)
题号:3187848
题型:填空题
难易度:一般
日期:2016-01-04
来源:2015-2016学年福建省四地六校高二上学期11月联考化学试卷(带解析)
【题文】如图所示,甲、乙两池的电极材料都是铁棒与碳棒,丙池是电解精炼铜。


(1)甲池中盛有CuSO
4溶液,反应一段时间后,有红色物质析出的是
棒,甲池中铁电极上电极反应式是
。
(2)乙池中盛有饱和NaCl溶液,总反应的化学方程式为
。若往乙池中滴入酚酞试液,
电极(填“Fe”或“C”)附近呈现红色。反应一段时间后,若要使溶液恢复到电解前的状态,可以向溶液中通入一定量的
。
(3)丙池中粗铜电极发生
(填“氧化”或“还原”)反应,反应过程中,Cu
2+的浓度
(填“增大”、“减小”或“不变”)。
题号:4304214
题型:填空题
难易度:较难
日期:2016-01-04
来源:2015-2016学年福建省四地六校高二上学期11月联考化学试卷(带解析)
【题文】空气中CO
2的含量及有效利用,已经引起各国的普遍重视
Ⅰ: 目前工业上有一种方法是用CO
2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的恒容密闭容器中,充入1mol CO
2和3mol H
2,一定条件下发生反应:
CO
2(g)+3H
2(g)

CH
3OH(g)+H
2O(g) ,△H=-49.0kJ/mol;测得CO
2和CH
3OH(g)的浓度随时间变化如图甲所示。
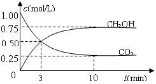
(1)前3min内,平均反应速率v(H
2)=
mol·L
-1·min
-1。此温度下该反应的平衡常数为
(保留两位小数,注意要写单位)。
(2)下列措施中,既能使反应加快,又能使n(CH
3OH)/n(CO
2)增大的是
。
A.升高温度 B.充入惰性气体
C.将H
2O(g)从体系中分离 D.再充入1mol H
2(3)图乙中t
5时引起平衡移动的条件是
。(填序号)

A.升高温度 B.增大反应物浓度 C.使用催化剂 D.增大体系压强
(4)反应达到平衡后,若向反应体系再加入CO
2(g)、H
2(g) 、CH
3OH(g)、H
2O(g)各1mol,化学平衡
(填“正向”、“逆向”或“不”)移动。
Ⅱ:利用CO
2(g)+CH
4(g)

2CO(g)+2H
2(g)将CO
2转化成燃料气。T℃时,在恒容密闭容器中通入物质的量均为0.1 mol的CH
4与CO
2,发生上述反应,吸收热量Q
1kJ,测得CH
4的平衡转化率与温度及压强的关系如图所示

(5)下列事实能说明该反应达到平衡的是( )
a.CO的物质的量不再发生变化
b.混合气体的密度不再发生变化
c.v正(CO
2)= 2v逆(H
2)
d.混合气体压强不再发生变化
e.单位时间内生成n mol CH
4的同时消耗2n mol H
2(6)据图可知P
1、P
2、P
3、P
4由小到大的顺序是
。
(7)若将上述容器改为恒压容器(反应前体积相同),起始时通入物质的量均为0.1 mol的CH
4与CO
2,相同的温度下充分反应达到平衡后,放出热量Q
2 kJ,
则Q
1 Q
2(填 “>”“=”或“<”)
Ⅲ: 设反应①Fe(s)+CO
2(g)

FeO(s)+CO(g) 和反应②Fe(s)+H
2O(g)

FeO(s)+H
2(g)的平衡常数分别为K
1、K
2,在不同温度下, K
1、K
2的值如下表所示:
T(K)
| K1
| K2
|
973
| 1.47
| 2.36
|
1173
| 2.15
| 1.67
|
(8)现有反应CO
2(g)+H
2(g)

CO(g)+H
2O(g),是
(填“吸”或“放”)热反应。

 xW(g)+U(g),某温度下,将等物质的量的P与Q投入体积固定2L密闭容器中,经5min后到达平衡,5min内W的平均反应速率是0.2 mol·L-1•min-1,平衡时U的浓度为0.5 mol·L-1,[P]:[Q]=1:2,下列说法错误的是
xW(g)+U(g),某温度下,将等物质的量的P与Q投入体积固定2L密闭容器中,经5min后到达平衡,5min内W的平均反应速率是0.2 mol·L-1•min-1,平衡时U的浓度为0.5 mol·L-1,[P]:[Q]=1:2,下列说法错误的是
 bB(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度变为原来的60%,则
bB(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度变为原来的60%,则 pC(g)+ qD(g)反应过程中,其他条件不变时,D的百分含量与温度(T)或压强(P)关系如图所示,反应达平衡后,下列叙述正确的是
pC(g)+ qD(g)反应过程中,其他条件不变时,D的百分含量与温度(T)或压强(P)关系如图所示,反应达平衡后,下列叙述正确的是

 NH3(g)+H2S(g)在一定温度下达到平衡,下列情况不能使平衡发生移动的是
NH3(g)+H2S(g)在一定温度下达到平衡,下列情况不能使平衡发生移动的是 2PbSO4+2H2O。
2PbSO4+2H2O。

 2HI(g)△H=-QkJ/mol(Q>0),H-H键能为akJ/mol,H-I键能为bkJ/mol,则I-I键能是
2HI(g)△H=-QkJ/mol(Q>0),H-H键能为akJ/mol,H-I键能为bkJ/mol,则I-I键能是 2C(g)+2D(g),在不同情况下测得反应速率如下,其中反应速率最快的是
2C(g)+2D(g),在不同情况下测得反应速率如下,其中反应速率最快的是



 CH3OH(g)+H2O(g) ,△H=-49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图甲所示。
CH3OH(g)+H2O(g) ,△H=-49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图甲所示。

 2CO(g)+2H2(g)将CO2转化成燃料气。T℃时,在恒容密闭容器中通入物质的量均为0.1 mol的CH4与CO2,发生上述反应,吸收热量Q1kJ,测得CH4的平衡转化率与温度及压强的关系如图所示
2CO(g)+2H2(g)将CO2转化成燃料气。T℃时,在恒容密闭容器中通入物质的量均为0.1 mol的CH4与CO2,发生上述反应,吸收热量Q1kJ,测得CH4的平衡转化率与温度及压强的关系如图所示
 FeO(s)+CO(g) 和反应②Fe(s)+H2O(g)
FeO(s)+CO(g) 和反应②Fe(s)+H2O(g) FeO(s)+H2(g)的平衡常数分别为K1、K2,在不同温度下, K1、K2的值如下表所示:
FeO(s)+H2(g)的平衡常数分别为K1、K2,在不同温度下, K1、K2的值如下表所示: CO(g)+H2O(g),是 (填“吸”或“放”)热反应。
CO(g)+H2O(g),是 (填“吸”或“放”)热反应。