适用年级:{{getGradeNameByProperty('高二|月考试卷|福建|2013年')}} 试卷类型:{{getTestPaperTypeName('高二|月考试卷|福建|2013年')}} 使用省份:{{getAreaName('高二|月考试卷|福建|2013年')}}
试卷年份:{{getYear('高二|月考试卷|福建|2013年')}}上传日期:2013-12-03题数:20
提示:单击题文可显示答案与解析。
题号:3261210
题型:选择题
难易度:一般
日期:2013-12-03
来源:2013-2014学年福建省四地六校高二上学期第二次月考化学试卷(带解析)
【题文】下列事实
不能用勒夏特列原理解释的是
| A.开启啤酒瓶后,瓶中马上泛起大量泡沫 |
| B.H2、I2、HI混合气体加压后颜色变深 |
| C.红棕色的NO2加压后颜色先变深再变浅 |
| D.工业上生产硫酸的过程中使用过量的空气,以提高二氧化硫的利用率 |
题号:3261211
题型:选择题
难易度:一般
日期:2013-12-03
来源:2013-2014学年福建省四地六校高二上学期第二次月考化学试卷(带解析)
【题文】对于反应3Fe(s)+4H
2O(g)

Fe
3O
4(s)+4H
2(g)的平衡常数,下列说法正确的是
A.K= |
B.K= |
| C.增大c(H2O)或减小c(H2),会使该反应平衡常数减小 |
| D.改变反应的温度,平衡常数不一定变化 |
题号:3261212
题型:选择题
难易度:一般
日期:2013-12-03
来源:2013-2014学年福建省四地六校高二上学期第二次月考化学试卷(带解析)
【题文】一定质量的混合气体在密闭容器中发生如下反应:xA(g)+yB(g)

zC(g)。达到平衡后,测得A气体的浓度为0.5mol/L。当恒温下将密闭容器的容积扩大到原来的二倍,再达平衡后,测得A的浓度为0.3mol/L。下列叙述正确的是
| A.平衡向正反应方向移动 | B.x+y<z |
| C.C的体积分数降低 | D.B的转化率增大 |
题号:3261213
题型:选择题
难易度:一般
日期:2013-12-03
来源:2013-2014学年福建省四地六校高二上学期第二次月考化学试卷(带解析)
【题文】已建立化学平衡的某可逆反应X(g)+2Y(g)

2Z(g),当条件改变使化学平衡向正反应方向移动时,下列叙述正确的是
①生成物的质量分数一定增加,②生成物总量一定增加, ③反应物的转化率一定增大,
④反应物的浓度一定降低,⑤正反应速率一定大于逆反应速率,⑥一定使用催化剂
题号:3261214
题型:选择题
难易度:一般
日期:2013-12-03
来源:2013-2014学年福建省四地六校高二上学期第二次月考化学试卷(带解析)
【题文】将等物质的量的F
2和ClF混合,在密闭容器中发生反应:F
2(g)+ClF(g)

ClF
3(g) ΔH<0。下列叙述正确的是
| A.保持恒容,平衡后再降低温度,平衡常数减小 |
| B.若增加F2的用量,平衡正向移动,则反应物的转化率均增大 |
| C.达到平衡后,若增大容器体积,则正反应速率减小,逆反应速率增大,平衡左移 |
| D.恒温恒容时,当ClF转化40%时,容器内的压强为初始时的0.8 |
题号:3261215
题型:选择题
难易度:一般
日期:2013-12-03
来源:2013-2014学年福建省四地六校高二上学期第二次月考化学试卷(带解析)
【题文】298K时,在FeCl
3酸性溶液中加少量锌粒后,Fe
3+ 立即被还原 成Fe
2+。据此某学习小组设计如图所示的原电池装置。下列有关说法正确的是:

| A.正极反应为Zn-2e-→Zn2+ |
| B.左烧杯中溶液的红色变浅 |
| C.Pt电极上有气泡出现 |
| D.该电池总反应为3Zn+2Fe3+=2Fe+3Zn2+ |
题号:3261216
题型:选择题
难易度:一般
日期:2013-12-03
来源:2013-2014学年福建省四地六校高二上学期第二次月考化学试卷(带解析)
【题文】对于可逆反应:aA(g)+bB(g)

mC(g)+ nD(g);△H<0,下列说法正确的是
| A.浓度改变平衡必移动 | B.增大压强平衡必移动 |
| C.升高温度平衡必移动 | D.导入氦气平衡必移动 |
题号:3261217
题型:选择题
难易度:一般
日期:2013-12-03
来源:2013-2014学年福建省四地六校高二上学期第二次月考化学试卷(带解析)
【题文】镍(Ni)镉(Cd)可充电的电池,放电时,电极材料是Cd和NiO(OH),电解质是KOH,电极反应分别是:Cd+2OH
--2e
-=Cd(OH)
2 ;2NiO(OH)+2H
2O+2e
-=2Ni(OH)
2+2OH
-。下列说法不正确的是
| A.电池放电时,负极周围溶液的pH不断减小 |
| B.电池放电时总反应是Cd+2NiO(OH)+2H2O=Cd(OH)2+2Ni(OH)2 |
| C.电池充电时,镉(Cd)元素被氧化 |
| D.电池充电时,电池的正极和电源的正极相连接 |
题号:3261218
题型:选择题
难易度:一般
日期:2013-12-03
来源:2013-2014学年福建省四地六校高二上学期第二次月考化学试卷(带解析)
【题文】已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q
1、Q
2均为正值):
H
2(g)+Cl
2(g)=2HCl(g) ΔH=-Q
1 kJ/mol
H
2(g)+Br
2(g)=2HBr(g) ΔH=-Q
2 kJ/mol
有关上述反应的叙述正确的是
| A.Q1<Q2 |
| B.生成物总能量均高于反应物总能量 |
| C.生成1molHCl气体时放出Q1热量 |
| D.1molHBr(g)具有的能量大于1molHBr(l)具有的能量 |
题号:3261219
题型:选择题
难易度:一般
日期:2013-12-03
来源:2013-2014学年福建省四地六校高二上学期第二次月考化学试卷(带解析)
【题文】在如图所示的装置中,a为Fe,b为碳棒,关于此装置的各种叙述正确的是
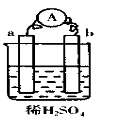
| A.a电极上有气体放出,b电极上无气泡,溶液pH变大 |
| B.a是正极,b是负极 |
| C.导线中有电子流动,外电路中,电子从a极到b极 |
| D.a极上发生了还原反应 |
题号:3261220
题型:选择题
难易度:一般
日期:2013-12-03
来源:2013-2014学年福建省四地六校高二上学期第二次月考化学试卷(带解析)
【题文】下列关于能量转换的认识中不正确的是
| A.原电池工作时化学能全部转化为电能 |
| B.工业上电解氧化铝制备铝,电能转化成化学能 |
| C.镁在空气中燃烧时化学能不只转变成热能 |
| D.绿色植物光合作用过程中太阳能转变成化学能 |
题号:4319414
题型:选择题
难易度:一般
日期:2013-12-03
来源:2013-2014学年福建省四地六校高二上学期第二次月考化学试卷(带解析)
【题文】家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是
| A.4Fe(OH)2+2H2O+O2=4Fe(OH)3↓ |
| B.2Fe+2H2O+O2=2Fe(OH)2↓ |
| C.2H2O+O2+4e-=4OH- |
| D.Fe-3e-=Fe3+ |
题号:4319415
题型:选择题
难易度:一般
日期:2013-12-03
来源:2013-2014学年福建省四地六校高二上学期第二次月考化学试卷(带解析)
【题文】在298 K、100 kPa时,已知:
2H
2O(g)=O
2(g)+2H
2(g);ΔH
1Cl
2(g)+H
2(g)=2HCl(g);ΔH
22Cl
2(g)+2H
2O(g)=4HCl(g)+O
2(g);ΔH
3则ΔH
3与ΔH
1和ΔH
2间的关系正确的是
| A.ΔH3=ΔH1+2ΔH2 | B.ΔH3=ΔH1+ΔH2 |
| C.ΔH3=ΔH1-2ΔH2 | D.ΔH3=ΔH1-ΔH2 |
题号:4319416
题型:选择题
难易度:一般
日期:2013-12-03
来源:2013-2014学年福建省四地六校高二上学期第二次月考化学试卷(带解析)
【题文】下列各组反应(表中物质均为反应物):则反应刚开始时,放出H
2的速率最大的是
编号
| 金属(粉末状) /mol
| 酸的浓度与体积
| 反应温度
|
A
| Mg 0.1
| 6mol/L HNO3 10 mL
| 60 ℃
|
B
| Mg 0.1
| 3mol/L HCl 10 mL
| 60 ℃
|
C
| Fe 0.1
| 3mol/L HCl 10 mL
| 60 ℃
|
D
| Mg 0.1
| 3mol/L H2SO4 10 mL
| 60 ℃
|
题号:4319417
题型:选择题
难易度:一般
日期:2013-12-03
来源:2013-2014学年福建省四地六校高二上学期第二次月考化学试卷(带解析)
【题文】化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如下图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是
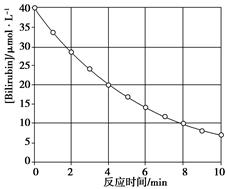
| A.2.5μmol·L-1·min-1和2.0μmol·L-1 |
| B.2.5μmol·L-1·min-1和2.5μmol·L-1 |
| C.3.0μmol·L-1·min-1和3.0μmol·L-1 |
| D.5.0μmol·L-1·min-1和3.0μmol·L-1 |
题号:4319418
题型:选择题
难易度:一般
日期:2013-12-03
来源:2013-2014学年福建省四地六校高二上学期第二次月考化学试卷(带解析)
【题文】把下列4种X的溶液分别加入4个盛有10mL2mol·L
-1盐酸的烧杯中,均加水稀释到50 mL,此时X和盐酸缓和地进行反应。其中反应速率最大的是
| A.20mL3mol·L-1的X溶液 | B.20mL2mol·L-1的X溶液 |
| C.10mL4mol·L-1的X溶液 | D.10mL2mol·L-1的X溶液 |
题号:3261206
题型:填空题
难易度:困难
日期:2013-12-03
来源:2013-2014学年福建省四地六校高二上学期第二次月考化学试卷(带解析)
【题文】研究NO
2、SO
2 、CO等大气污染气体的测量及处理具有重要意义。
(1)I
2O
5可使H
2S、CO、HC1等氧化,常用于定量测定CO的含量。已知:
2I
2(s)+5O
2(g)=2I
2O
5(s) △H=-75.56 kJ·mol
-12CO(g)+O
2(g)=2CO
2(g) △H=-566.0 kJ·mol
-1写出CO(g)与I
2O
5(s)反应生成I
2(s)和CO
2(g)的热化学方程式:
。
(2)一定条件下,NO
2与SO
2反应生成SO
3和NO两种气体:NO
2(g)+SO
2(g)

SO
3(g)+NO(g)将体积比为1∶2的NO
2、SO
2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO
3和NO的体积比保持不变
d.每消耗1molSO
2的同时生成1molNO
测得上述反应平衡时NO
2与SO
2体积比为1∶6,则平衡常数K=
。
(3)从脱硝、脱硫后的烟气中获取二氧化碳,用二氧化碳合成甲醇是碳减排的新方向。将CO
2转化为甲醇的热化学方程式为:CO
2 (g)+3H
2(g)

CH
3OH(g)+H
2O(g) △H
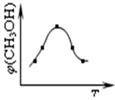
3①取五份等体体积CO
2和H
2的的混合气体 (物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH
3OH) 与反应温度T的关系曲线如图所示,则上述CO
2转化为甲醇反应的△H
3 0(填“>”、“<”或“=”)。
②在容积为1L的恒温密闭容器中充入1molCO
2和3molH
2,进行上述反应。测得CO
2和CH
3OH(g)的浓度随时间变化如下左图所示。若在上述平衡体系中再充0.5molCO
2和1.5mol水蒸气(保持温度不变),则此平衡将
移动(填“向正反应方向”、“不”或“逆反应方向”)。

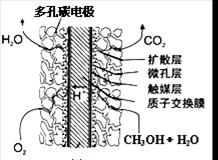
③直接甲醇燃料电池结构如上右图所示。其工作时负极电极反应式可表示为
。
题号:3261207
题型:填空题
难易度:较难
日期:2013-12-03
来源:2013-2014学年福建省四地六校高二上学期第二次月考化学试卷(带解析)
【题文】向2L密闭容器中加入一定量的A、B、C三种气体,一定条件下发生反应,各物质的物质的量随时间变化如图甲所示[t
0~15 s阶段n(B)未画出]。图乙为t
2时刻后改变条件平衡体系中反应速率随时间变化的情况,且四个阶段所改变的外界条件均不同。已知t
3~t
4阶段为使用催化剂。观察下图,回答以下问题:
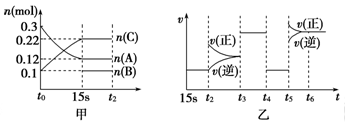
(1)甲图中从反应至达到平衡状态,生成物C的平均反应速率为____________________。
(2)图乙中t
2时引起平衡移动的条件是______,t
5时引起平衡移动的条件是_______。(填序号)
A.升高温度 B.增大反应物浓度 C.使用催化剂 D.减少体系压强
(3)图乙中表示平衡混合物中,在这四个阶段中C的物质的量最高的一段时间是______。(填序号): A.15s-t
2时段 B.t
3-t
4时段 C.t
4-t
5时段 D.t
6以后
(4)该反应的化学方程式可以表示为:_______________________________________________________,
正反应为______________(填“放热”或“吸热”)反应。
(5)反应开始时加入的B的物质的量为________________。
题号:3261208
题型:填空题
难易度:一般
日期:2013-12-03
来源:2013-2014学年福建省四地六校高二上学期第二次月考化学试卷(带解析)
【题文】工业上合成氨的热反应方程式如下:N
2(g)+3H
2(g)

2NH
3(g) △H=-92 kJ/mol
(1)若已知破坏1mol
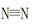
键、H—H键键分别需吸收的能量为946 kJ、436 kJ,则断开1molN—H需吸收的能量为
kJ。
(2)在恒温恒压的条件下,将2mol N
2和6molH
2通入一容积可变的容器中反应,达到平衡后气体的体积为反应前的75%,则该过程释放的能量为
kJ,氮气的转化率为
,平衡后氨气占混合气体的体积分数为
。
(3)若将1mol N
2和1molH
2通入两个相同体积的密闭容器甲和乙中,甲容器保持温度和体积不变,乙容器保持温度和压强不变,经过一段时间后,两容器均达到平衡状态。
①建立平衡所需的时间:甲
乙(填“>”,“<”或“=”)
②达到平衡后氨气的体积分数:甲
乙(填“>”,“<”或“=”)
题号:3261209
题型:填空题
难易度:一般
日期:2013-12-03
来源:2013-2014学年福建省四地六校高二上学期第二次月考化学试卷(带解析)
【题文】如图为电解装置,X、Y为电极材料,a为电解质溶液。
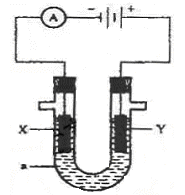
(1)若a为含有酚酞的KCl溶液,X为Fe,Y为石墨,电解一段时间后:
X电极附近可观察到的实验现象是
;
写出Y电极的电极反应式
。
(2)若要实现Cu +H
2SO
4=CuSO
4+H
2↑,
则Y电极材料是
;
写出X电极的电极反应式
。
(3)若要利用该装置在铁制品表面镀上一层银,则a为
,反应前两电极的质量相等,反应后电极质量相差2.16g,则该过程理论上通过电流表的电子数为
。
(4)若X、Y均为惰性电极,a为NaOH溶液,电解一段时间后,溶液的pH
(填“增大”“不变”“减小”),若要使溶液恢复原来的状态,可往溶液中加入
。
 Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是

 zC(g)。达到平衡后,测得A气体的浓度为0.5mol/L。当恒温下将密闭容器的容积扩大到原来的二倍,再达平衡后,测得A的浓度为0.3mol/L。下列叙述正确的是
zC(g)。达到平衡后,测得A气体的浓度为0.5mol/L。当恒温下将密闭容器的容积扩大到原来的二倍,再达平衡后,测得A的浓度为0.3mol/L。下列叙述正确的是 2Z(g),当条件改变使化学平衡向正反应方向移动时,下列叙述正确的是
2Z(g),当条件改变使化学平衡向正反应方向移动时,下列叙述正确的是 ClF3(g) ΔH<0。下列叙述正确的是
ClF3(g) ΔH<0。下列叙述正确的是
 mC(g)+ nD(g);△H<0,下列说法正确的是
mC(g)+ nD(g);△H<0,下列说法正确的是

 SO3(g)+NO(g)将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
SO3(g)+NO(g)将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3



 2NH3(g) △H=-92 kJ/mol
2NH3(g) △H=-92 kJ/mol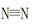 键、H—H键键分别需吸收的能量为946 kJ、436 kJ,则断开1molN—H需吸收的能量为 kJ。
键、H—H键键分别需吸收的能量为946 kJ、436 kJ,则断开1molN—H需吸收的能量为 kJ。