适用年级:{{getGradeNameByProperty('高三|月考试卷|福建|2016年')}} 试卷类型:{{getTestPaperTypeName('高三|月考试卷|福建|2016年')}} 使用省份:{{getAreaName('高三|月考试卷|福建|2016年')}}
试卷年份:{{getYear('高三|月考试卷|福建|2016年')}}上传日期:2016-04-22题数:13
提示:单击题文可显示答案与解析。
题号:1236855
题型:选择题
难易度:容易
日期:2016-11-29
来源:2016届福建省福安市高级中学高三3月月考化学试卷(带解析)
【题文】Si、SiO
2广泛用于制造晶体管、光导纤维等。下列有关说法正确的是
| A.附着油污的晶体管可用碱液浸泡 |
| B.光导纤维遇碱会影响光信号传输 |
| C.工业上用SiO2热分解法冶炼硅 |
| D.自然界中硅以游离态形式存在 |
题号:1301815
题型:选择题
难易度:一般
日期:2016-10-12
来源:2016届福建省福安市高级中学高三3月月考化学试卷(带解析)
【题文】N
A为阿伏加德罗常数的值。下列说法正确的是
| A.3.2gCH3OH含有的化学键数为0.4NA |
| B.0.1molFeCl3水解制得的Fe(OH)3胶体中胶粒数是0.1NA |
| C.标准状况下,2.24LCl2溶于足量水,转移的电子数为0.1NA |
| D.0.2gD216O中含有的质子数、中子数和电子数均为0.1NA |
题号:3138802
题型:选择题
难易度:一般
日期:2016-05-11
来源:2016届福建省福安市高级中学高三3月月考化学试卷(带解析)
【题文】分子式为C
5H
10O
2并能与NaOH溶液反应的有机构有(不含立体异构)
题号:3143555
题型:选择题
难易度:一般
日期:2016-04-22
来源:2016届福建省福安市高级中学高三3月月考化学试卷(带解析)
【题文】X、Y、Z、W四种主族元素分属于元素周期表的前三周期,原子序数依次增加,它们原子的最外层电子数之和为15,Y
2 -和Z
2+的电子层结构相同。下列说法正确的是
| A.氢化物的沸点:Y<W |
| B.简单离子的半径:W>Y>Z>X |
| C.W的氧化物对应的水化物是一种强酸 |
| D.与Z同族的下一周期元素的单质不能与N2反应 |
题号:3143577
题型:选择题
难易度:一般
日期:2016-04-22
来源:2016届福建省福安市高级中学高三3月月考化学试卷(带解析)
【题文】下列说法不正确的是( )
| A.84消毒液含有次氯酸钠,洁厕灵中含有盐酸,二者混合使用会产生氯气使人中毒。 |
| B.输送氯气的管道漏气,可以用浓氨水检验,是因为氯气和氨气发生化合反应生成氯化铵. |
| C.因氯气消毒过的自来水不宜直接用来养金鱼,最好在阳光下晒一段时间。 |
| D.氯气和二氧化硫均有漂白性,二者按体积比1:1混合后不能是有色布条褪色。 |
题号:4302284
题型:选择题
难易度:一般
日期:2016-04-22
来源:2016届福建省福安市高级中学高三3月月考化学试卷(带解析)
【题文】下列实验中,所采取的实验方法(或操作)与对应的原理都正确的是
选项
| 实验
| 方法(或操作)
| 原理
|
A
| 分离溶于水中的溴
| 裂解汽油萃取
| 碘在裂解汽油中的溶解度较大
|
B
| 分离乙酸乙酯和乙醇
| 分液
| 乙酸乙酯和乙醇的密度不同
|
C
| 从蛋清中提取蛋白质
| 加入硫酸铜溶液
| 浓盐溶液使蛋白质溶解度降低
|
D
| 尿液中尿糖的检验
| 加入新制Cu(OH)2、加热
| 葡萄糖具有还原性
|
题号:4302286
题型:选择题
难易度:一般
日期:2016-04-22
来源:2016届福建省福安市高级中学高三3月月考化学试卷(带解析)
【题文】含硝基苯(C
6H
5NO
2)的工业废水常用铝粉处理。其机理为:在溶液中,铝单质提供电子将硝基(-NO
2)还原为-NH
2,还原快慢受废水pH影响。下列图示中,能正确反映废水的pH与硝基苯被还原速率(
v)关系的是

题号:3143554
题型:实验题
难易度:较难
日期:2016-04-22
来源:2016届福建省福安市高级中学高三3月月考化学试卷(带解析)
【题文】醋酸亚铬水合物[Cr(CH
3COO)
2]
2.2H
2O是一种氧气吸收剂,为红棕色晶体,易被氧
化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂)。其制备装置及步骤如下:

①检查装置气密性后,往三颈瓶中依次加入过量锌粒、适量CrCl
3溶液。
②关闭k2.打开ki,旋开分液漏斗的旋塞并控制好滴速。
③待三颈瓶内的溶液由深绿色(Cr
3+)变为亮蓝色(Cr
2+)时,把溶液转移到装置乙中,当出现大量红棕色晶体时,关闭分液漏斗的旋塞。
④将装置乙中混合物快速过滤、洗涤和干燥,称量得到2.76 g[Cr(CH
3COO)
2]
2.2H
2O。
(1)装置甲中连通管a的作用是____。
(2)三颈瓶中的Zn除了与盐酸生成H
2外,发生的另一个反应的离子方程式为
。
(3)实现步骤③中溶液自动转移至装置乙中的实验操作为
。
(4)装置丙中导管口水封的目的是____。
(5)洗涤产品时,为了去除可溶性杂质和水分,下列试剂的正确使用顺序是_______(填标号)。
a.乙醚 b.去氧冷的蒸馏水 c.无水乙醇
(6)若实验所取用的CrCl
3溶液中含溶质3.17 g,则[Cr(CH
3COO)
2]
2.2H
2O(相对分子质量为376)的产率是____。
(7)一定条件下,[Cr(CH
3COO)
2]2.2H
2O受热得到CO和CO
2的混合气体,请设计实验检验这两种气体的存在__________________。
题号:3143552
题型:填空题
难易度:较难
日期:2016-04-22
来源:2016届福建省福安市高级中学高三3月月考化学试卷(带解析)
【题文】【化学——选修3物质结构与性质】现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题:
A元素原子的核外p电子总数比s电子总数少1
|
B元素原子p电子总数与s电子总数相等,且不与A元素在同一周期
|
C原子所有轨道全满或半满
|
D元素的主族序数与周期数的差为4
|
E是前四周期中电负性最小的元素
|
F在周期表的第七列
|
(1)A基态原子中能量最高的电子,其电子云在空间有_____个方向,原子轨道呈______形。
(2)某同学根据上述信息,所画的B原子的电子排布图为
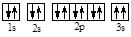
,违背了________原理。
(3)F位于______族_____区,其基态原子电子有______种运动状态,价电子排布式为______。
(4)CD
3中心原子的杂化方式为_______,用价层电子对互斥理论推测其分子空间构型为_______。检验E元素的方法是___________。
(5)HA
3是一种弱酸,可部分电离出H
+和A
3-。配合物[Co(A
3)(AH
3)
5]SO
4中的配体是_______(填化学式),钴离子的配位数是_________。
题号:3143553
题型:填空题
难易度:困难
日期:2016-04-22
来源:2016届福建省福安市高级中学高三3月月考化学试卷(带解析)
【题文】软锰矿制取碳酸锰(MnCO
3)流程如下:

其中,还原焙烧主反应为:2MnO
2+C=2MnO+CO
2↑。根据要求回答问题:
(1)步骤D中Fe
2+被氧化,该反应的离子方程式为
。
(2)步骤H的离子方程式为
。
(3)加入Na
2S可以除去Pb
2+、Al
3+等离子。已知
Ksp(PbS)=1×10
-28 Ksp(MnS)= 1×10
-9.6,当溶液中
c(Pb
2+)=1×10
-5mol·L
-1时,溶液中
c(Mn
2+)允许的最大值为
。
(4)pH=0的溶液中,不同价态锰的微粒的能量(△
G)如右图。
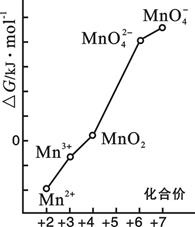
若某种含锰微粒(如Mn
3+)的能量处于相邻价态两种微粒(Mn
2+和MnO
2)能量连线左上方,则该微粒不稳定并发生歧化反应,转化为相邻价态的微粒。
①MnO
42—能否稳定存在于pH=0的溶液中?答:______________(“能”或“不能”);
②将Mn
3+歧化反应设计为原电池,可测定反应平衡常数。电池负极反应为
,平衡常数表达式为
;
③实验室可利用以下反应检验Mn
2+存在:2Mn
2+ + 5S
2O
82- + 8H
2O → 16H
+ + 10SO
42- + 2MnO
4-确认Mn
2+存在的现象是
;检验时必须控制Mn
2+浓度和用量不能过大,否则实验失败。理由是
。
题号:4302287
题型:填空题
难易度:较难
日期:2016-04-22
来源:2016届福建省福安市高级中学高三3月月考化学试卷(带解析)
【题文】碳是形成物种最多的元素之一,许多含碳物质对人类极其重要。

(1)石墨烯是一种由碳原子构成的单层片状结构的新材料,结构如右图所示。则12g石墨烯中含有
个6元环。
(2)工业上利用甲烷和氧气直接氧化制取甲醇的反应如下:
CH
4+
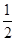
O
2(g)

CH
3OH(g) △H=-128.5kJ/mol
副反应有:
CH
4(g)+

O
2(g)

CO(g)+2H
2O(g) △H="a" kJ/mol
CH
4(g)+2O
2(g)

CO
2(g)+2H
2O(g) △H="b" kJ/mol
CH
4(g)+O
2(g)→HCHO(g) +H
2O(g) △H="c" kJ/mol
①若要有利于甲醇的生成,除了改变温度外,还可以采取的两种措施是
;
②甲醇与氧气反应生成HCHO(g)和水蒸汽的热化学方程式为
。
(3)苯乙烷(C
8H
10)生产苯乙烯(C
8H
8)的反应:C
8H
10(g)

C
8H
8(g)+H
2(g) ΔH>0。T
1℃下,将0.40 mol苯乙烷充入2 L密闭容器中反应,不同时间容器内n(C
8H
10)如下表:
时间/min
| 0
| 10
| 20
| 30
|
n(C8H10)/mol
| 0.40
| 0.30
| 0.26
| n2
|
①当反应进行到30 min时恰好到达平衡,则n
2取值的最小范围是________;
②改变温度为T
2℃,其他条件不变,测得平衡时容器内气体压强为反应前的1.4倍,则此时苯乙烷的转化率为
。
(4)用惰性电极电解葡萄糖和硫酸钠混合溶,可以制得葡萄糖酸[CH
2OH(CHOH)
4COOH]和己六醇[CH
2OH(CHOH)
4CH
2OH]。葡萄糖酸在
极生成,对应的电极反应式
。
题号:4302288
题型:填空题
难易度:较难
日期:2016-04-22
来源:2016届福建省福安市高级中学高三3月月考化学试卷(带解析)
【题文】【化学——选修2化学与技术】
由黄铜矿(主要成分是CuFeS
2)炼制精铜的工艺流 程示意图如下:
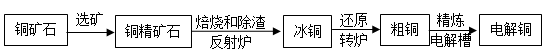
(1)在反射炉中,把铜精矿砂和石英砂混合加热到l000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物。
①该过程中两个主要反应的化学方程式分别是__________、__________;
②反射炉内生成炉渣的主要成分是__________。
(2)冰铜(Cu
2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu
2S被氧化为Cu
2O。生成的Cu
2O与Cu
2S反应,生成含Cu量约为98.5%的粗铜。该过程发生反应的化学方程式分别是__________、__________。
(3)粗铜的电解精炼如右图所示。
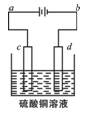
①在粗铜的电解过程中,粗铜板应是图中电极_____(填图中的字母);
②在电极d上发生的电极反应式为____________;
③若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为______。
题号:4302289
题型:推断题
难易度:困难
日期:2016-04-22
来源:2016届福建省福安市高级中学高三3月月考化学试卷(带解析)
【题文】[化学——选修5:有机化学基础] A(C
2H
2)是基本有机化工原料。由A制备聚乙烯醇缩丁醛和顺式异戊二烯的合成路线(部分反应条件略去)如图所示:
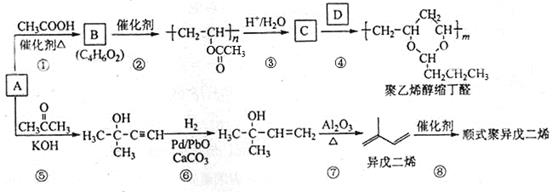
回答下列问题:
(1)A的名称是
,B含有的官能团是
。
(2)①的反应类型是
,⑦的反应类型是
。
(3)C和D的结构简式分别为
、
。
(4)异戊二烯分子中最多有
个原子共平面,顺式聚异戊二烯的结构简式为
。
(5)写出与A具有相同官能团的异戊二烯的所有同分异构体
(写结构简式)。
(6)参照异戊二烯的上述合成路线,设计一条由A和乙醛为起始原料制备1,3—丁二烯的合成路线
。


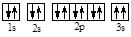 ,违背了________原理。
,违背了________原理。


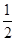 O2(g)
O2(g) CH3OH(g) △H=-128.5kJ/mol
CH3OH(g) △H=-128.5kJ/mol O2(g)
O2(g) CO(g)+2H2O(g) △H="a" kJ/mol
CO(g)+2H2O(g) △H="a" kJ/mol CO2(g)+2H2O(g) △H="b" kJ/mol
CO2(g)+2H2O(g) △H="b" kJ/mol C8H8(g)+H2(g) ΔH>0。T1℃下,将0.40 mol苯乙烷充入2 L密闭容器中反应,不同时间容器内n(C8H10)如下表:
C8H8(g)+H2(g) ΔH>0。T1℃下,将0.40 mol苯乙烷充入2 L密闭容器中反应,不同时间容器内n(C8H10)如下表:

