
| A.50oC,PH在3~6之间,X降解率随pH增大而减小 |
| B.pH=2,温度在40~80oC,X降解率随温度升高而增大 |
| C.无需再进行后续实验,就可以判断最佳反应条件是:PH=3、温度为80oC |
| D.pH=2、温度为50oC,10min内v(X)=1.44x10-4mol·L-1min-1 |
 Al2O3+3H2,电解过程中,以下判断正确的是
Al2O3+3H2,电解过程中,以下判断正确的是| | 电池 | 电解池 |
| A | H+移向Pb电极 | H+移向Pb电极 |
| B | 每消耗3 molPb | 生成2 molAl2O3 |
| C | 正极:PbO2+4H++2e-===Pb2++2H2O | 阳极:2Al+3H2O-6e-===Al2O3+6H+ |
| D | 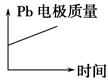 |  |

A.N2(g) + 3H2(g)  2NH3(g) ΔH =-Q1 kJ·mol-1 (Q1>0) 2NH3(g) ΔH =-Q1 kJ·mol-1 (Q1>0) |
B.2SO3(g)  2SO2(g) + O2(g)ΔH =" +" Q2 kJ·mol-1 (Q2>0) 2SO2(g) + O2(g)ΔH =" +" Q2 kJ·mol-1 (Q2>0) |
C.4NH3(g) + 5O2(g)  4NO(g) + 6H2O(g)ΔH =-Q3 kJ·mol-1 (Q3>0) 4NO(g) + 6H2O(g)ΔH =-Q3 kJ·mol-1 (Q3>0) |
D.H2(g) + CO(g)  C(s) + H2O(g)ΔH =" +" Q4 kJ·mol-1 (Q4>0) C(s) + H2O(g)ΔH =" +" Q4 kJ·mol-1 (Q4>0) |


| A.实验2比实验1的反应容器体积减小 |
| B.实验2比实验l使用了效率更高的催化剂 |
| C.实验2和实验3可判断该反应是放热反应 |
| D.实验1比实验3的平衡常数大 |
 H++OH-,下列叙述正确的是
H++OH-,下列叙述正确的是| A.将纯水加热到950C时,Kw变大,pH不变,水仍呈中性 |
| B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小 |
| C.向水中加入少量固体硫酸氢钠,c(H+)增大,平衡逆向移动,KW不变 |
| D.向水中通入HCl气体,平衡逆向移动,溶液导电能力减弱 |
| A.c(OH-)<c(H+)的溶液 | B.含有较多H+的溶液 |
| C.pH<7的溶液 | D.能与金属Al反应放出H2的溶液 |
 C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是
C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是| A.①④⑤⑥ | B.只有④ | C.②③④ | D.全部 |
| A.溶液中OH-向正极移动,K+、H+向负极移动 |
| B.锌发生还原反应,氧化银发生氧化反应 |
| C.锌是负极,氧化银是正极 |
| D.在电池放电过程中,负极区溶液碱性增强 |

| A.用图①装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液 |
| B.图②装置的盐桥中KCl的Cl-移向乙烧杯 |
| C.图③装置中钢闸门应与外接电源的负极相连获得保护 |
| D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同 |
| A.pH=1的溶液中:Na+、Fe2+、NO3-、SO42- |
| B.滴入酚酞试液显红色的溶液中:K+、Fe3+、ClO-、SO42- |
| C.c(H+)/c(OH-)=1×1012的溶液中:NH4+、Cl-、NO3-、Al3+ |
| D.由水电离出的c(H+)=1×10-12mol/L的溶液中:Na+、K+、Cl-、HCO3- |
| A.用蒸馏水湿润的pH试纸测量某溶液的pH=10 |
| B.推广使用太阳能、风能、海洋能,有利于缓解温室效应 |
| C.向铁钉上镀铜时,铁钉连接直流电源的正极 |
| D.需要加热才能发生的反应一定是吸热反应 |
A.对于2SO2(g)+O2(g)  2SO3(g) ΔH=-QkJ·mol-1,(Q>0),若反应中充入1molSO2和足量的氧气反应时,放出的热量一定是Q/2 kJ 2SO3(g) ΔH=-QkJ·mol-1,(Q>0),若反应中充入1molSO2和足量的氧气反应时,放出的热量一定是Q/2 kJ |
| B.Zn(s)+H2SO4(aq) ===ZnSO4(aq)+H2(g) ΔH<0,该反应的化学能可以转化为电能 |
C.N2(g)+3H2(g) 2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大 2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大 |
| D.水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
| A.△H1>0,△H3<0 | B.△H2>0,△H4>0 |
| C.△H1=△H2+△H3 | D.△H3=△H4+△H5 |
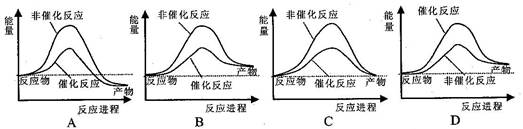
 2NH3(g) △H<0已达到平衡,只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是
2NH3(g) △H<0已达到平衡,只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是| A.K值不变,平衡可能移动 | B.K值变化,平衡一定移动 |
| C.平衡移动,K值可能不变 | D.平衡移动,K值一定变化 |
 CO2(g)+H2(g) ,反应过程中测定的部分数据见下表(表中t1<t2)。
CO2(g)+H2(g) ,反应过程中测定的部分数据见下表(表中t1<t2)。| 反应时间/min | n(CO)/mol | n(H2O)/ mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | | 0.20 |
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol·L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol·L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol·L-1FeCl3溶液 |


 CO2(g)+H2(g)△H>0
CO2(g)+H2(g)△H>0 
| A.升高温度 |
| B.加入催化剂 |
| C.增大压强 |
| D.增加CO的浓度 |


